注册管理征求意见稿“十八连发” 解码三大焦点和立项机会
发布时间:2020-05-25 16:31:52作者:本报特约撰稿 边界来源:医药经济报
注册管理征求意见稿“十八连发”
解码三大焦点和立项机会
赶在2020年“五一劳动节”前,国家药监局和药品审评中心接连发布多个影响制药行业的征求意见稿,号称“征求意见稿十八连发”,让这个“五一劳动节”多了许多功课,要非常努力非常爱劳动。其实,“十八连发”主要针对的是《药品注册管理办法》(总局令第27号)的执行细则。笔者总结“十八连发”的三大焦点,以及接下来在立项中可能遇到的问题。
焦点一
注册分类变化
充分考虑各类药品的特殊性
在新注册分类中,化学药品注册分类依然沿用此前的化学药品注册分类,注册类别分为5类。生物制品分为3类,分别为预防用生物制品、治疗用生物制品和按生物制品管理的体外诊断试剂,其中预防用生物制品和治疗用生物制品分为3类,按生物制品管理的体外诊断试剂则分为2类。中药目前分为4类。
新注册分类以创新、改良、仿制作为大体系框架,又充分考虑了各类药品的特殊性。化学药将境外重点单独做了个分类,这也是化学药分类比中药和生物制品多的原因。
其中,中药创新药的定义与分类备受关注。根据刚刚发布的《中药注册分类及申报资料要求2020》,中药创新药是指含有未在国家药品标准及药品注册标准(处方)中收载的中药新处方,具有临床价值,且未在境外上市的制剂。又分为1.1(中药复方制剂)、1.2(单一植物、动物、矿物等的提取物及其制剂)、1.3(新药材及其制剂)三类。其中,中药复方也纳入创新药了。
2类改良型新药是个亮点,无论是化学药、生物药还是中药,都有较为细致的分类与解释。
再以3类生物制品为例,都是境内或境外已上市的生物制品。若是预防用生物制品(疫苗),就分为3.1(境外已上市的疫苗申报进口)、 3.2(境外已上市、境内未上市的疫苗申报在境内生产上市)和3.3(境内已上市疫苗)三种类别。若是治疗用生物制品,则分为3.1(境外已上市的生物制品申报进口)、3.2 (境外已上市、境内未上市的生物制品申报在境内生产上市)、3.3(生物类似药)、3.4(不能按生物类似药研发申报的其它生物制品)。其中,治疗用生物制品3.4类究竟何指令人困惑。
焦点二
“临床需求”“临床优势”贯穿
期盼更细致的“临床优势”评判标准
“临床需求”和“临床优势”基本贯穿整个注册分类。例如境外上市境内未上市的改良型药品,在征求意见稿被列为5.1类,而没有单列一个分类,但必须具备明显的临床优势。
那么临床需求如何体现?《境外已上市境内未上市药品临床技术要求(征求意见稿)》可以提供一些参考。
“临床需求”必须结合我国的流行病学研究和目前国内的药用指南综合分析来确定临床需求的程度。临床缺乏有效治疗手段的危重疾病和罕见病治疗药品,则以解决公众用药可获得性为首要前提进行审评审批。
临床评价包括了有效性和安全性评价、种族敏感性分析,以及基于中国患者获益风险评估进行决策。值得注意的是,对药品的认识不应该仅仅限于注册阶段的临床数据,还要考虑上市后再评价的临床数据。
《境外已上市境内未上市药品临床技术要求(征求意见稿)》明确了可接受的临床试验应按照国际通行GCP开展,且通过监管机构临床试验核查,保证临床试验数据具有真实性、准确性、完整性和可溯源性。但是,在监管机构无法对境外上市原研药品临床试验数据进行核查的情况下,可考虑接受境外先进监管机构(如美国FDA、欧盟EMA、日本PMDA)的核查结果和结论——这意味着可接受在美欧日上市且具备临床试验的产品。
然而,《境外已上市境内未上市药品临床技术要求(征求意见稿)》依然没有明显的临床优势的评判标准,毕竟境外批准新剂型、新给药途径、新规格时未必会完全考虑临床优效(只要求临床有效或效益大于风险),但是在可及性、依从性等方面能够较现有药物有优势。例如眼药水减少防腐剂,又如已上市单方组成的复方制剂、普通改缓释更多是为了患者服药方便,口服改贴剂是为了减少不良反应。因此,笔者认为,改良药更应该从药物经济学角度出发,如果改良的药物能够降低患者的成本(包括使用成本)并且和原研等效,就应该予以考虑批准。
焦点三
新增减免临床机会点
重大利好点:跨国药企、中药复方
减免临床一向是业界所关注的“机会”点。
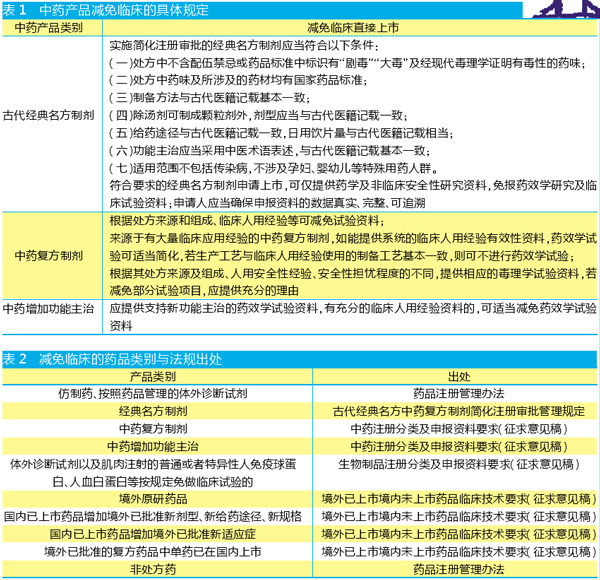
目前来看,在上市前有机会获得减免临床的产品类别包括:仿制药,按照药品管理的体外诊断试剂,经典名方制剂,中药复方制剂,肌肉注射的普通或者特异性人免疫球蛋白、人血白蛋白,境外原研药品,国内已上市药品增加境外已批准新剂型、新给药途径、新规格,境外已批准的复方药品中单药已在国内上市,以及非处方药。相关药品都有望在上市前减免临床直接申报上市。此外,中药增加功能主治,以及国内已上市药品增加境外已批准新适应症,也有希望减免临床。
刚刚发布的《境外已上市境内未上市药品临床技术要求(征求意见稿)》,对境外原研药品,国内已上市药品增加境外已批准新剂型、新给药途径、新规格,境外已批准的复方药品中单药已在国内上市等类别药品可以减免的情况做了详细解释。这意味着相关项目只要数据可靠,就有望加快进入国内上市。
对于境外已上市境内未上市药品的仿制药临床试验要求,需考虑原研药品临床评价结果及制剂学两个方面的因素。业界认为这是药监部门全面认可境外已上市境内未上市药品的临床数据,新3类有望减免验证性临床。实际上,还是要根据境外已上市境内未上市药品的临床数据质量和是否具备人种差异等多方面因素作评估,能否减免只能具体问题具体分析。
中药方面,依据刚刚发布的《中药注册分类及申报资料要求(征求意见稿)》,新纳入了中药复方制剂、中药增加功能主治两种豁免的具体细则。此前发布的《古代经典名方中药复方制剂简化注册审批管理规定》,对经典名方制剂的减免临床条件提出了细致的规定。对于中药复方制剂的规定是,“根据处方来源和组成、临床人用经验等可减免试验资料”,对有详细临床观察记录的院内制剂打开了一扇大门。
生物药方面,《生物制品注册分类及申报资料要求(征求意见稿)》明确,对于体外诊断试剂以及肌肉注射的普通或者特异性人免疫球蛋白、人血白蛋白,可以直接提出上市申请。
鉴于医保部门认为甲类OTC依然属于医保产品,预计甲类OTC的改剂型会是近期企业关注的热点。跨国药企的全球数据有望被认可直接上市,对于跨国药企是较大利好。
★★★ 总结 ★★★
立题依据作为药品研发的基石,变得非常重要。创新药要考虑临床需求,改良药要有临床优效的预判,仿制药要考虑规避竞争。中药政策算是放开,但上市了也要面临销售难题。找好项目难,将是行业的普遍问题。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






