Ⅱ类医械报告数最多 注册人用户同比增41.92%
发布时间:2020-05-22 18:04:44作者:本报记者 胡睿来源:医药经济报
《国家医疗器械不良事件监测年度报告(2019年)》发布
Ⅱ类医械报告数最多 注册人用户同比增41.92%
4月29日,国家药品监督管理局网站对外发布了《国家医疗器械不良事件监测年度报告(2019年)》(以下简称《报告》)。
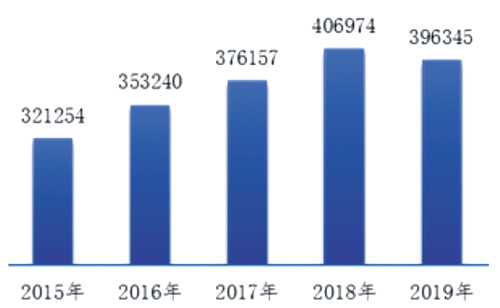
《报告》显示,2019年,国家医疗器械不良事件监测信息系统共收到可疑医疗器械不良事件报告396345份,比上年减少2.61%。
图1 2015-2019年全国可疑医疗器械不良事件报告数量
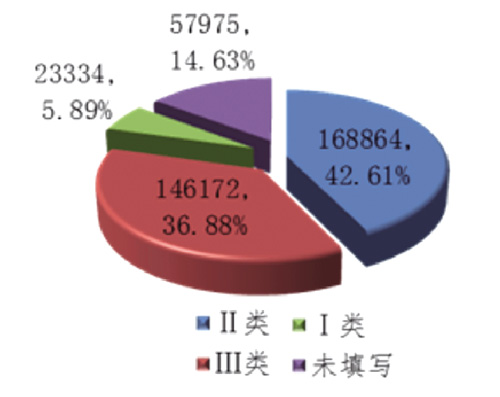
从医疗器械管理类别分析,占比最高的为Ⅱ类医疗器械,报告数168864份,占报告总数的42.61%;其次为Ⅲ类医疗器械的146172份,占报告总数的36.88%;涉及Ⅰ类医疗器械的报告23334份,占报告总数的5.89%;未填写医疗器械管理类别的报告57975份,占报告总数的14.63%。
图2 2019年可疑医疗器械不良事件报告涉及医疗器械管理类别情况
而按医疗器械分类目录来看,报告数量排名前五位的医疗器械类别为:14-注输、护理和防护器械,07-医用诊察和监护器械,09-物理治疗器械,22-临床检验器械,08-呼吸、麻醉和急救器械。
国家药监局医疗器械监督管理司相关负责人表示,近年来,医疗器械风险治理机制有效运行,重点在于风险监测持续加强和监督抽验稳步提升两方面。监督检查力度持续加大,其中,监督检查领域不断扩大,医疗器械生产企业飞行检查力度逐步加大,医疗器械境外检查稳步推进,监管基础建设不断夯实。
维护产品动态信息
医疗器械不良反应监测一直是国家药监局工作的重中之重。2018年,国家药监局对外发布《医疗器械不良事件监测和再评价管理办法》,强化持有人不良事件监测和再评价主体责任;发布《医疗器械生产企业管理者代表管理指南》,落实企业体系运行主体责任。
报告显示,2019年,国家医疗器械不良事件监测信息系统接收可疑医疗器械不良事件报告39万余份,每百万人口平均报告数为297份,全国96.70%的区县报告了医疗器械不良事件,系统基层注册用户达到31万余家。其中,注册人19662家,占用户总数的6.16%;经营企业178295家,占用户总数的55.89%;使用单位121029家,占用户总数的37.94%。
与2018年相比,注册基层用户总数比增长15.69%。注册人注册基层用户比上年增长41.92%,经营企业和使用单位的注册基层用户分别比上年增长24.22%和2.28%。
发布工作指南
为指导和规范医疗器械注册人、备案人(简称注册人)开展不良事件监测工作,国家药品监督管理局还组织制定了《医疗器械注册人开展不良事件监测工作指南》(以下简称《指南》)。4月10日,该《指南》已在国家药监局网站正式对外发布。
《指南》要求,注册人承担医疗器械不良事件监测主体责任,应当建立医疗器械不良事件监测工作制度,配备数量与其规模相适应的人员从事医疗器械不良事件监测工作,主动收集、上报、调查、分析、评价医疗器械不良事件,及时采取有效措施控制风险并发布风险信息,对上市医疗器械的安全性进行持续研究,按要求开展风险评价及重点监测工作并提交相关报告,积极配合药品监督管理部门和监测机构开展医疗器械不良事件监测相关工作。
境外注册人还应当与指定代理人建立信息传递机制,及时互通医疗器械不良事件监测和再评价信息。
同时,《指南》也明确,注册人还应当注册为国家医疗器械不良事件监测信息系统(以下简称“系统”)用户,通过系统报告医疗器械不良事件相关信息,并及时维护用户和产品注册信息。注册信息发生变化的应当立即在系统中进行更新。
新旧系统平稳过渡
相关负责人表示,“与2018年相比,全国医疗器械不良事件报告数量保持平稳,系统基层注册用户数量持续增加,新旧医疗器械不良事件监测信息系统实现平稳过渡”。
2019年,国家医疗器械不良事件监测信息系统收到的可疑医疗器械不良事件报告中,使用单位上报357799份,占报告总数的90.27%;注册人上报8600份,占报告总数的2.17%;经营企业上报29833份,占报告总数的7.53%;其他来源的报告113份,占报告总数的0.03%。
报告中,事件伤害程度为“死亡”的报告213份,占报告总数的0.05%;事件伤害程度为“严重伤害”的报告26723份,占报告总数的6.74%;事件伤害程度为“其他”的报告369408份,占报告总数的93.20%。
相关负责人介绍,“对于事件伤害程度为‘死亡’的可疑医疗器械不良事件报告,国家药品不良反应监测中心均及时进行了处置,督促注册人开展调查、评价。在目前完成分析评价的事件中,1.41%的事件与涉及的医疗器械有关联性。后续监测中,尚未发现上述事件涉及医疗器械风险异常增高情况”。
《报告》还显示,按照医疗器械结构特征分析,2019年国家医疗器械不良事件监测信息系统收到的可疑医疗器械不良事件报告中,涉及无源医疗器械的报告251465份,占报告总数的63.45%;涉及有源医疗器械的报告83954份,占报告总数的21.18%;涉及体外诊断试剂的报告2935份,占报告总数的0.74%;未填写医疗器械结构特征的报告57991份,占报告总数的14.63%。
重点监测100个品种
记者了解到,与大多数国家一样,我国医疗器械不良事件报告通过自发报告系统收集并录入到数据库中,即当怀疑某种事件可能与医疗器械有关时,就可以上报。受报告者主观意识、经验水平、认知程度甚至所持立场等影响,医疗器械不良事件的报告可能存在片面性和局限性,如伤害程度判读不准确、报告填写不规范、信息不完善等,甚至将与医疗器械无关的事件也按照不良事件上报,因此统计结果与实际发生的医疗器械不良事件情况存在偏差。
近年来,国家药监局为加强不良事件监测,组织实施不良事件监测和再评价管理办法,做好重点监测。相关负责人表示,“国家局还将继续组织做好100个医疗器械品种的不良事件的重点监测。”按照“十三五”国家药品安全规划工作要求,2020年末完成100个医疗器械品种的重点监测工作。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






