27批参比制剂大汇总 三焦点立项考量
发布时间:2020-05-21 17:13:11作者:本报特约撰稿 边界来源:医药经济报
根据最新的化学药注册申请征求意见稿,“仿制药申请,原则上应在所选参比制剂纳入参比制剂公布目录后提出。相关技术指导原则不推荐参比制剂的品种除外。所选参比制剂未纳入参比制剂目录的,在申报前应与药审中心沟通交流并达成一致意见后,方可提交”。这意味着没有在参比制剂公布目录内的仿制药注册,都需要尽快申报参比制剂了,毕竟从申报参比制剂到征求意见再到正式公布,也需要几个月的时间。
从参比制剂目录可以看出国内的仿制方向。自2017年3月第一批参比制剂目录公布,截至2020年5月12日,已有二十七批正式目录公布,涉及品规3302个。结合新规,哪些是行业内的关注点?这些关注点又有哪些注意事项?
[焦点1]
欧美日仿制药:都有望成为参比制剂?
提问:仿制不同上市国的药品,如何避免仿制药质量不一致?
值得注意的是,参比制剂不再硬性要求一定是原研药品了。原研药品是指境内外首个获准上市,且具有完整和充分的安全性、有效性数据作为上市依据的药品。参比制剂是指经国家药品监督管理部门评估确认的用于仿制药研制使用的对照药品。
根据新法规的征求意见稿要求,仿制药研发时应首先确定参比制剂,通常应选择具有充分有效性和安全性数据的原研产品,且主要为欧盟EMA、美国FDA和日本PMDA批准上市并被列为参比制剂的药品。同时,应根据“关于发布化学仿制药参比制剂遴选与确定程序的公告(2019年第25号)”要求,对所选参比制剂进行认定。
以唑来膦酸注射液为例,国内进口的是100mL:5mg(以唑来膦酸无水物计),欧美日的4mg:100ml都可视为参比制剂。
最近比较热门的阿加曲班,原研药为田边三菱1990年上市的10mg/20ml安瓿瓶。医疗机构强烈要求改进配方需求下,以“减少了安瓿瓶切开时对伤害的恐惧”,“在制备药液时提高便利性并减少工作量”,“减少安瓿切割过程中玻璃碎裂的风险”,“减少产品存储空间”,“减轻处置负担”,日本原研方田边三菱开发小型安瓿瓶配方,成功配制出浓度更高的常规配方的1/10体积(10mg/2mL)配方,并于2005年3月获得批准。
沢井制药株式会社的阿加曲班注射液20ml:10mg规格在2001年7月上市,上市时间早于田边三菱的2ml:10mg规格,初步判断沢井制药的阿加曲班注射液上市时仿制的是田边三菱首次开发的20ml:10mg制剂,而田边三菱20ml:10mg制剂被2ml:10mg规格替代后于2006年3月停产。2019年10月,沢井制药阿加曲班注射液的20ml:10mg规格也以田边三菱2ml:10mg规格为标准品进行了对比研究。
在仿制药第二十六批征求意见稿中,CDE公布的未通过审议参比制剂品种目录中提到,经一致性评价专家委员会审议,沢井制药的20ml:10mg为改规格品种,已发布原研进口为参比制剂,原研无此规格,正式稿就没有将沢井制药的20ml:10mg列入参比制剂。
然而进入美国橙皮书的,分别是在2011年和2016年上市的Eagle Pharmaceuticals Inc和Hikma Pharm Co Ltd的阿加曲班注射液/阿加曲班氯化钠注射液50mg/50ml(1mg/ml),最终进入了国家参比制剂的名单(第二十六批)公布。
由此可见,日本原研仍在上市的规格,还有美国橙皮书认可的都可以视为参比制剂。但是,不同国家上市的产品有可能产地不一,个别质量指标数据也有差异。那么,只要和欧美日三个上市地任一上市的质量一致,是否就可以获批通过一致性评价呢?如果是,那么市场上就会出现仿制不同上市国产品,从而导致质量不一致的仿制药产品。
[焦点2]
化药3类:规格用法可与参比制剂不一致?
提问:带量采购纳入合并规格、剂型的竞争!新规格是否带来新适应症?
化学药品3类为境内生产的仿制境外已上市境内未上市原研药品的药品。征求意见稿提出,在有研究数据证明合理性的情况下,规格和用法用量可以与参比制剂不一致。
改变规格有的是从人种的特殊情况出发,有的其实是想走独家规格路线规避竞争。然而,最近带量采购纳入合并规格、合并同类剂型之间的竞争。除非新规格带来新的适应症,或者新的适应症单独有儿科的而且带量采购默许儿童的规格可以直接挂网采购,否则新规格未必能规避竞争,反而因为新增适应症增加了研发成本。
[焦点3]
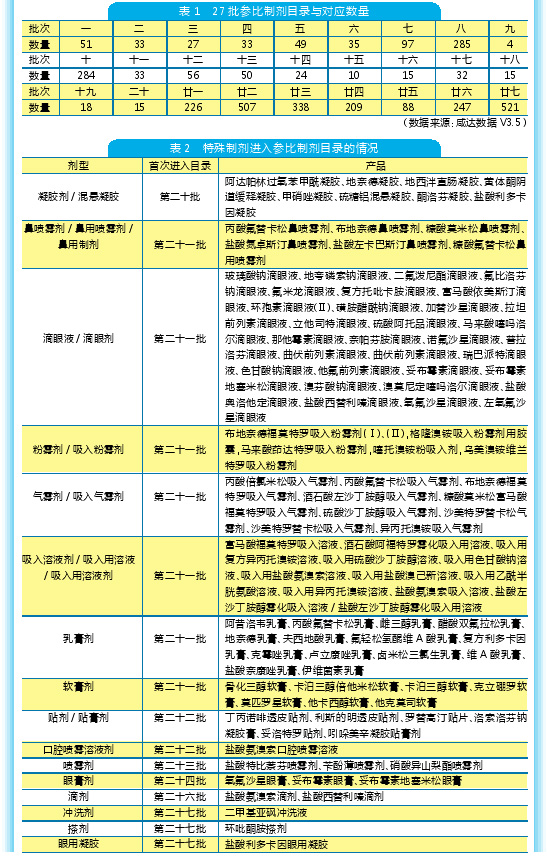
特殊制剂:滴眼剂、吸入剂进入目录最多
提问:若多家上市,面临集采!高门槛高研发投入还能盈利吗?
自第21批的产品出现注射剂之后,多西他赛、泮托拉唑这些销售额排名前列的注射剂都进入了参比制剂目录。
特殊制剂进入参比制剂目录也是从第21批开始的,例如鼻用制剂,基本上都是鼻喷雾剂,但剂型在不同批次的写法不一样。
从特殊制剂目前申报的产品来看,销售额潜力较大、国内刚上市的进口产品都已列入参比制剂目录。从参比制剂目录可以看出国内的仿制方向,滴眼剂、吸入剂最多品种进入参比制剂目录,这一方面与这类产品的品种数较多有关,另一方面可以看出滴眼剂是各个企业关注的方向。滴眼剂的门槛是决定这类产品竞争态势的关键因素——多家上市会面临集采,滴眼液的市场究竟能容纳多少家竞争厂家?如果门槛高意味研发投入大,需要考虑:多家竞争后所投入的费用面对带量采购会不会直接就变成“坏账”了?
★★★ 总结 ★★★
如果未来必须要先有参比制剂才能注册仿制药产品,就会面临凡是进入参比制剂目录的产品都会成为仿制药厂家模仿的对象。争首仿的厂家们如果看到已有竞争产品备案自己的标的产品,也就知道自己的进度落后了。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






