2019注册总数保持高位运行 今年医械注册五点预判
发布时间:2020-04-24 18:35:14作者:特约撰稿 韩健春来源:医药经济报
国家药监局近期发布了《2019年度医疗器械注册工作报告》,总结了2019年我国医疗器械注册工作的总体情况,报告中还公布了注册受理与审批工作的相关数据,引起了业界的极大关注。
报告显示,2019年,我国医疗器械注册管理法规体系不断完善,医疗器械审评审批制度改革深入推进,智慧监管与科学监管取得实际成效,自主创新产品百花齐放,医疗器械注册产品显著增长。
回顾去年注册工作动态,审评审批改革体现了“放管服”的改革思想
“放”方面
国家药监局对医疗器械的监管逐步由重准入监管向重日常监管转变。例如,在注册端优化临床试验审批程序,由“明示”许可调整为“默示”许可;基于产品风险考虑,新增和修订的免于进行临床试验医疗器械目录,新增148项医疗器械和23项体外诊断试剂免于进行临床试验。
“管”方面
国家药监局发布了《定制式医疗器械监督管理规定(试行)》和《医疗器械生产质量管理规范附录独立软件》等重要法规,制定了57项医疗器械技术审查指导原则和72项行业标准,医疗器械注册的法规依据日臻完善;启动了医疗器械唯一标识系统试点,强化了源头赋码,有助于通过唯一标识实现全链条医疗器械通查通识,加强医疗器械全生命周期管理;先后对近60家生产企业进行飞行检查,对多家企业实施限期整改或继续停产整改,提升了法规的震慑性;同时分2批对20个医疗器械临床试验项目进行监督检查,对16个注册项目开展临床试验样本真实性延伸核查;根据相关线索组织对部分企业开展核查,对通过虚假资料进行注册的行为进行了严厉打击。
“服”方面
国家药监局聚焦“互联网+医疗器械政务服务”, 建立了注册电子申报信息系统(eRPS),实现注册申报网上办理,节约资料流转时间,大大减轻了企业申报负担;同时构建了立卷审查制度,在技术审评前对申报资料完整性、合规性、一致性进行判断,解决企业提供补正资料时的“留尾巴”现象,防止申请人提交不完整或不合理的申报资料而耗费有限的审评资源,有效提升了注册申报资料质量。医疗器械注册人制度试点也继续推进至北京、江苏等21个省、自治区和直辖市,共有93个产品获批上市,进一步释放了制度红利,为全面实施医疗器械注册人制度提供了重要支撑。
纵观产品注册数据,加速发展的趋势没有改变
注册总数保持高位运行
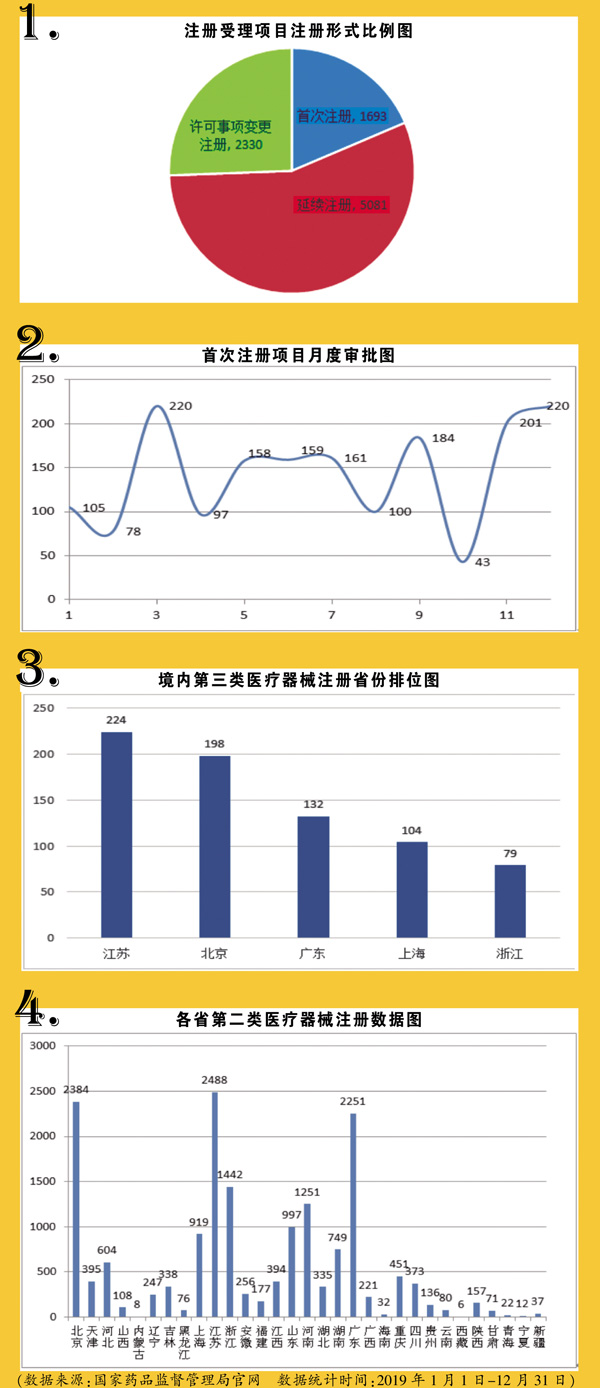
2019年,国家药监局共受理医疗器械首次注册、延续注册和许可事项变更注册申请9104项,同比增加37.8%;共批准医疗器械首次注册、延续注册和变更注册8471项,同比增长53.2%。其中,批准境内三类注册3179项,同比增长86.0%。国内器械产品注册已保持多年快速增长。随着进口替代、注册人制度实施等因素叠加,未来前景十分可观。
器械产业聚集地强者恒强
与2018年相比,长三角、珠三角和京津冀依旧全国领跑,其中苏京粤沪浙作为传统五强地位稳固,占据境内三类器械三分之二(2/3),产业聚集效应明显。注册强代表着研发强,也意味着医疗器械的生产能力和消费能力的强劲,与地区经济发展状况基本一致。
进口器械注册增长放缓
相对于国产器械的突飞猛进,进口器械注册产品增长脚步放缓,注册以延续注册和变更注册居多。2019年进口三类器械首次注册375项,同比仅增长15%。且进口一类器械备案总数大幅减少20.7%,这也反映了国内产品在中低端市场渐成主流,进口器械进入难度加大,预计进口替代未来将聚焦在高端器械市场。
创新器械动力不减
2019年,国家药监局共收到创新医疗器械特别审批申请179项,36项获准进入特别审查程序。收到优先申请31项,12项获准予以优先审批,共批准19个创新医疗器械产品上市。虽然2019年创新器械获批数量同比略有减少,但创新通过比例却有所增加,反映了监管机构大力推动医疗器械创新,鼓励创新器械快速上市的决心。
结合当下疫情新特点,展望今年注册工作值得期待
预判1.医疗器械监督管理条例及其配套法规有望年内发布。新版条例是未来器械监管的根本大法,条例的更新必将对医疗器械产品研制、生产、经营和使用带来深远影响,推动行业持续变革与发展。
预判2.首次注册数量会显著增长。一是受进口器械转境内生产政策的带动,进口器械本地化进程加快。二是由于新冠肺炎疫情的爆发,今年的应急审批数量大幅增加,尤其是口罩、防护服等防护类器械将呈现井喷态势。
预判3.注册人制度将全面铺开。今年在新版医疗器械监督管理条例的催生下,医疗器械注册人制度有望在全国推广实施,注册主体和生产主体的分离,无疑为器械市场注入了一支强心剂,跨区监管的实施及进口器械能否适用于该制度将引发业界关注。
预判4.注册检验逐步放开,免临床试验器械范围继续扩大。注册检验和临床试验一直是医疗器械注册上市的两大制约因素,未来只有在合理控制风险的基础上进一步松绑才能优化医疗器械上市周期,激发市场活力。
预判5.应急审批、附条件上市等注册管理更为规范。疫情之下,应急审批及附条件上市为急需器械快速上市立下了汗马功劳,大批应急器械得以快速上市。如何在满足市场需求的前提下做好上市后监管工作,控制好已上市产品的风险,是今年需要深入研究的问题。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






