高端仿制药入局 普瑞巴林竞争形势更显严峻
发布时间:2020-04-12 20:26:40作者:许诺来源:医药经济报
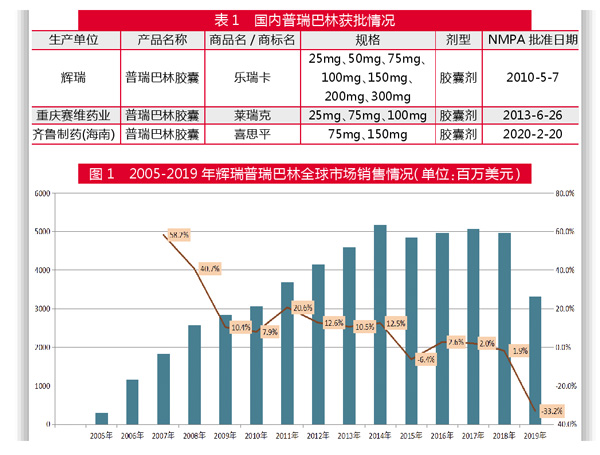
2月20日,齐鲁制药的普瑞巴林胶囊仿制药获NMPA批准上市,商标名为“喜思平”,规格有75mg、150mg两种。本次齐鲁制药获批后,视同首家通过一致性评价。
目前,国内获批普瑞巴林胶囊的企业包括原研辉瑞、重庆赛维和齐鲁制药,还没有企业获批缓释片剂型。从国内市场来看,普瑞巴林胶囊国内上市以来销量一直稳步增长,自纳入 2017 版国家医保目录后,市场快速放量。齐鲁高端仿制药快速入局,将进一步加剧国内镇痛药的竞争形势。
最畅销的镇痛药
普瑞巴林由美国辉瑞公司研制开发,于2004年12月获得FDA批准上市,商品名为“Lyrica”,获批剂型有胶囊和口服液。其中,胶囊的规格有25mg、50mg、75mg、100mg、150mg、225mg、200mg和300mg。主要用于带状疱疹后神经痛、纤维肌痛、糖尿病性外周神经痛和4岁及以上患者癫痫部分发作等的治疗。此外,欧洲EMA于2006年3月还批准普瑞巴林用于治疗广泛性焦虑(GAD),该产品具有抗癫痫止痛和抗焦虑作用,已在全球 130多个国家和地区上市,是目前全球最畅销的镇痛药。
辉瑞的普瑞巴林胶囊于2010年7月获批进入中国,商品名为“乐瑞卡”,获批适应症为带状疱疹后疼痛。2013年6月,重庆赛维药业公司的普瑞巴林胶囊获批,商品名为“莱瑞克”,规格有25mg、75mg和100mg,适应症为成人部分性癫痫发作。
原研药专利过期阴影
辉瑞普瑞巴林专利于2018 年12月到期,为了应对普瑞巴林胶囊制剂专利悬崖带来的影响,辉瑞儿科癫痫项目的开展使其获得了额外6个月的市场独占期。
辉瑞Lyrica主要适应症获批情况如下:2004年7月年获欧盟批准用于管理外周神经病性疼痛及用作部分癫痫发作治疗;2004年12月在美国获批用于缓解糖尿病性外周神经病相关神经病性疼痛和带状疱疹后神经痛;2005年6月又获批用于成年癫痫患者部分性发作辅助治疗;2007年6月再获批用于治疗纤维肌痛;2012年6月FDA批准其用于治疗脊髓损伤相关性疼痛。
2017年10月,FDA批准普瑞巴林缓释剂型,商品名 “Lyrica CR”,用于成年人糖尿病周围神经病变(pDPN)相关的神经性疼痛管理等。
据全球畅销药数据统计,辉瑞普瑞巴林销售额从2005年的2.91亿美元增长到2012年的41.58亿美元;2013年销售额为45.95亿美元;2014年销售额为51.68亿美元;2018年销售额为49.70亿美元;2019年销售额 为33.21亿美元,较上年下降33%。
该产品上市以来一直保持高速增长态势,2012-2018年普瑞巴林全球销售额基本维持在40亿~50亿美元之间。其中销售峰值在2014年,随后平稳下滑,2019年降至33.21亿美元。
2019年7月,美国FDA同时批准了梯瓦制药、雷迪博士实验室等9家制药企业的普瑞巴林仿制药上市,9款仿制药同时成为Lyrica的首仿药。辉瑞普瑞巴林在美国市场上受到仿制药的冲击,导致全球销售额出现大幅下滑。
高端仿制药迎来机遇
辉瑞的普瑞巴林于2010年在国内上市,被批准用于治疗带状疱疹后神经痛。2018年1月,辉瑞普瑞巴林用于治疗纤维肌痛(FMS)新增适应症列入拟纳入优先审评第26批目录;2018年10月,普瑞巴林新增的纤维肌痛适应症上市申请获国家药监局批准。2017年普瑞巴林进入国家医保目录,为乙类,限制使用范围为“限带状疱疹患者的神经疼痛二线治疗”。进入医保目录后,该产品销售额快速增长,预计未来其在国内市场的潜力依旧巨大。
据国内样本医院数据统计,普瑞巴林用药金额从2012年的2168万元增长到2018年的9074万元。2012-2018年复合增长率为27%,2012-2017年市场较为缓和,2018年有较大提升,整体市场较同期增长56.6%。2018年国内样本医院普瑞巴林市场中,辉瑞的产品用药金额为6999万元,占77.1%,较上年增长51.3%;重庆赛维药业的产品用药金额为2095万元,占22.9%,较上年增长了77.4%。
2019年6月,重庆赛维药业普瑞巴林胶囊的一致性评价补充申请获得CDE承办受理。本次齐鲁制药的普瑞巴林胶囊在国内首家通过一致性评价后,将依托其在神经系统用药领域的优势渠道快速占领市场。
申报企业众多
普瑞巴林胶囊能够有效缓解各种疼痛性疾病,对各种神经性疼痛都有治疗效果,且耐受性良好,不良反应轻微,安全有效。2012年,齐鲁制药立项开发普瑞巴林胶囊,并加紧研制。2017年12月,按照最新注册分类提交了上市申请。2020年2月,最终获批上市。
目前,国内正在申请仿制普瑞巴林不同剂型的企业有20多家,包括江苏恒瑞医药、徐州恩华药业、四川科伦药业、浙江华海药业、北京四环制药等。申报的剂型有胶囊、缓释片、控释片、分散片、口服液、缓释胶囊等。
经检索CDE数据,目前国内申报普瑞巴林原料药及其制剂的企业众多。其中,普瑞巴林胶囊还有10多家企业处在上市申请中;新4类申报有:宁波美诺华天康药业、海南锦瑞制药、海南万玮制药、华润双鹤药业、石家庄龙泽制药、石药集团欧意药业等。进口5.2类申报临床和申报上市的有:印度瑞迪博士、弗马塞斯;缓释片有北京泰德、恒瑞、齐鲁、四川科伦;缓释胶囊有江苏恩华药业;分散片有北京润德康医药。控释片有辉瑞制药;口服液有辉瑞制药、贝克诺顿(浙江)制药、江苏恒瑞医药。
值得关注的是:2017年12月,华海药业的普瑞巴林胶囊获得美国FDA暂时批准文号;2019年12月,石药集团普瑞巴林胶囊的简约新药申请获得美国FDA批准。
★★★ 结语 ★★★
目前普瑞巴林已在全球众多国家上市,是神经镇痛领域的重磅炸弹级药物。普瑞巴林作为镇痛药物的佼佼者,自上市以来一直保持快速增长,与其他物相互作用小,且耐受性好,是开发的镇痛药中最有希望的药物之一。随着专利期的到来,普瑞巴林面对越来越多质优价廉国产仿制药的竞争。国内高端仿制药的崛起将为进一步扩大市场带来难得的机遇。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






