FDA审评提速 去年新药最快3个月获批
发布时间:2020-04-10 20:51:34作者:李勇来源:医药经济报
FDA审评提速
去年新药最快3个月获批
医药市场调研机构EvaluatePharma对2019年美国FDA药物评价与研究中心(CDER)和生物制品评价与研究中心(CBER)批准的49种新药的市场前景进行分析,预测这些药物上市第5年的销售额合计为271亿美元。该数字尽管不是创纪录的,但也并不令人失望,并且可以肯定的是,过去6年来FDA不断完善监管规范,新药审批提速。
多个审评路径提速
2019年显著改善的是突破性疗法(Breakthrough Therapy)这一途径的平均审批时间,为FDA自2013年实施该政策以来的最佳成绩,平均审评时间仅6.3个月。当年首次实施突破性疗法的资格认定,平均审评时间也为6.3个月,但当时只有3个项目使用了这种审评路径,而2019年有15个项目通过突破性疗法进行审批。
此外,2019年标准审评在中位数和均值指标上均达到了2010年以来的最佳成绩。与此同时,FDA力求把优先审评(Priority Review)的时间缩短至6个月,尽管尚未达到这一目标,但过去3年已取得一定进展,目前优先审评的平均时间大约为8个月。
去年,FDA批准新药无疑给业界以审批提速的感觉。统计自2010年以来审批最快的10种药物中,2019年占据2种:Trikafta (elexacaftor/ivacaftor/tezacaftor)和Enhertu(fam-trastuzumab deruxtecan-nxki)。去年还有多种药物快速获批:有11种药物在不到6个月的时间内获得批准,几乎占2019年所有提交上市申请项目的1/4。
值得注意的是,福泰制药(Vertex)的新型囊性纤维化三联复方药物Trikafta,它不仅是去年获批最快的药物(3.1个月),而且预计将成为商业上最为成功的新药。到2024年,Trikafta在美国的销售额预计将达到39亿美元。鉴于福泰制药在囊性纤维化药物领域的领导地位,这个数字将具有相当大的确定性。
阿斯利康(Astrazeneca)和第一三共(Daiichi Sankyo)联合开发的抗体药物偶联物(ADC)Enhertu也跻身批准最快药物的前十名,该药预计2024年在美国的销售额为14亿美元,不过其商业化前景尚存不确定性,主要源自Enhertu的毒性对其使用的影响,以及其在早期治疗方案中获批的机会。
9个潜在“重磅炸弹”
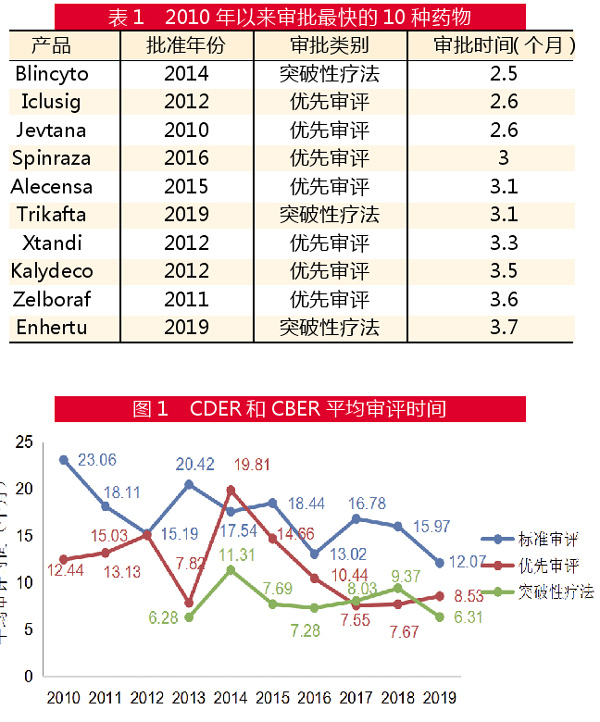
图2显示了去年获批新药的商业潜力,271亿美元的销售预测总值得益于潜在的9个“重磅炸弹”新药,其中4个预计到2024年将在美国带来20亿美元以上的收入。除Trikafta之外,还包括艾伯维(Abbvie)的2种新药:银屑病抗体Skyrizi(risankizumab)和用于类风湿性关节治疗的Jak抑制剂Rinvoq(upadacitinib)。
此外,辉瑞(Pfizer)的淀粉样变性病治疗药物Vyndaqel(tafamidis meglumine)也被认为具有“重磅炸弹”的潜力,预计2024年将达到25亿美元的销售额。值得注意的是,Vyndaqel与Trikafta都是罕见病新药,这也从侧面印证了该领域目前是制药公司的布局重点。
虽然FDA很愿意快速批准这些罕见病药物,但在审评Sarepta公司的杜氏肌营养不良症药物的问题上,FDA内部似乎存在分歧,这或许是业内对该领域药物开发需要注意的信号。
加速批准待完善
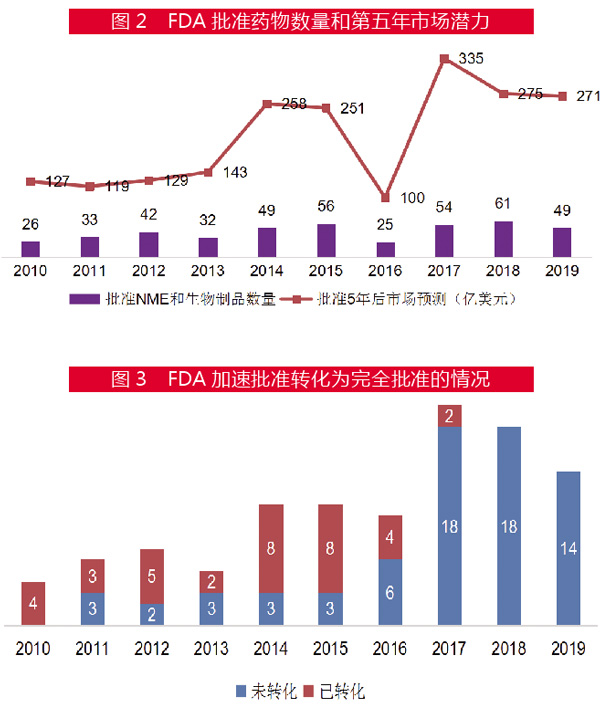
加速批准(Accelerated Approval)也是FDA四大特殊审评路径之一,2019年有14种新药通过这一路径获得了批准。在这一审评路径下,药物可以基于只有替代终点的临床试验快速获批,而不是传统使用直接衡量临床获益的数据。加速批准旨在迅速为患者提供重要的新疗法,不过,有批评声音指出,这一路径获批新药的真正疗效没有快速地得到确立。
FDA的加速批准程序一般包括首次批准和补充批准。抗癌药在这一审评路径中占主导地位,尤其是在最近几年。例如,Keytruda(pembrolizumab)已根据替代终点获得了14项批准,其中只有4项(肺癌、头和颈部肿瘤、黑色素瘤)已转换为完全批准。
值得注意的是,FDA通过加速批准上市的药物转化为完全批准的比率较低。一些已经上市一段时间的产品,其批准仍然缺乏足够的证据支持。例如,Amag公司2011年获得加速批准的早产治疗药物Makena(己酸羟孕酮)在Ⅲ期试验中未达其主要终点,而FDA也面临着要求该药撤市的压力。
此外,Keytruda去年在肝癌和胃癌试验中遭遇了失败,但FDA对于是否应该取消这些加速批准适应症一直未表态。而礼来(Eli Lilly)的Lartruvo(olaratumab)在一项证实性试验未能显示出对软组织肉瘤患者的益处后,在去年撤市了。
从行业的角度来看,尽管相关药品将首次批准转换为全面批准的情况与十年前相比可能有所改善,但企业对该工作的紧迫性不大。例如,葛兰素史克(Glaxosmithkline)的Tykerb(Lapatinib)花了8年多的时间将2010年加速批准治疗绝经后乳腺癌患者转换为正式批准,中等的疗效已经决定了该激酶抑制剂的命运,因此对投入时间更长、资金更多的进一步临床试验完全不着急。
大多数通过加速批准上市且尚未转换为完全批准的药物市场表现十分普通,例如,武田(Takeda)收购夏尔(Shire)获得的酶替代疗法Elaprase(idursulfase), Lakebeck公司用于治疗罕见病神经源性体位性低血压用药Northera(droxidopa),预计今年这两个产品在美国的销售额分别为3.64亿美元和1.77亿美元。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






