今年FDA新药审评有哪些看点?
发布时间:2020-04-08 11:15:06作者:本报记者 宋一宁来源:医药经济报
过去10年制药行业的蓬勃发展,很大程度上得益于以美国FDA为代表的药品审评部门不断摸索和实践日益灵活的监管制度。美国作为全球最大的药品市场,FDA所采取的一系列措施对于稳定投资者对制药领域的信心起到了重要作用。
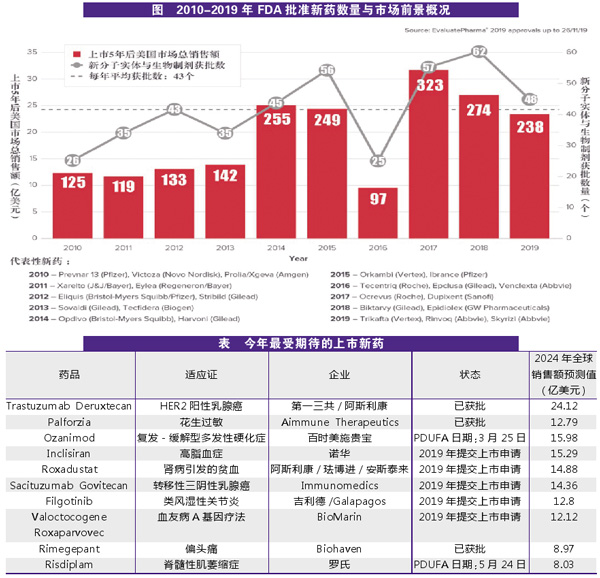
纵观十年来的美国新药批准情况,近几年药品获批数量总体呈现增加的趋势。这体现出FDA对于抗肿瘤领域、罕见病,以及目前治疗状况不佳的疾病领域的持续关注。
回顾2019
2019年,FDA药品评价与研究中心(CDER)共批准了48个新药,略高于最近十年的平均水平。据预测,这些药物在2024年的预期销售额总值达到238亿美元,这个数字在近十年获批的新药中属名列前茅。
不过,也有人担心过度使用加速审批的“绿色通道”会导致审评结果缺乏对药物临床试验的监督,使得这些新药既昂贵又无法改善现有治疗状况,甚至对患者不利。而在美国市场药价压力日益增加的背景下,FDA在2020年也将迎来挑战。
孤儿药数量再次超过抗癌药
根据FDA发布的2019年度新药审评报告,CDER批准的新药共计48个。其中,21个新药(44%)为治疗罕见病的孤儿药,20个(42%)为first-in-class新药,29个创新药(60%)至少获得FDA四大特殊审评通道中的一种。特殊审评的新药中有35%获得快速通道资格,27%获得突破性疗法认定,58%获得优先审评资格,19%获得加速批准。
与2018年相比,去年FDA批准的新药数量虽然减少了,但超过近十年的平均水平。尤其是2019年批准的新药中,首创新药(first-in-class)达到20种,占比42%。这类新药具有与现有疗法不同的作用机制,对全球患者的临床治疗方法革新有较大影响。
而在去年,21款孤儿药获批,这是继2018年后孤儿药获批数量再度超过抗肿瘤药,成为获批新药数目最多的领域。其中有2款罕见病药物的获批实现了该疾病领域用药从无到有的突破。
其一是2019年8月2日FDA批准的由第一三共开发的pexidartinib,用于治疗症状性腱鞘巨细胞瘤(TGCT)成人患者。这个疾病造成患者严重功能性限制,而且无法通过手术改善疾病症状。
另一款是2019年10月8日FDA批准的由Clinuvel制药研发的afamelanotide。该药用于治疗红细胞生成性原卟啉症(EPP)患者,EPP是一种对阳光敏感的罕见疾病,据估计全球大约有5000~10000例患者。
从审评速度来看,很多预期在2020年才能获批的重磅药物受益于FDA的绿色通道,提前到2019年获批。其中,福泰制药(Vertex)的最新囊性纤维化疗法Trikafta提前5个月于去年10月通过审批,GlobalBlood Therapeutics公司的镰状细胞疗法Oxbryta也提前3个月获得批准。EvaluatePharma预测,到2024年Trikafta的销售额将接近40亿美元,Oxbryta的销售额可能达到16亿美元。
与此同时,去年11月,诺华(Novartis)的Adakveo也获得FDA批准,用于减少镰状细胞病患者的疼痛发作频率。今年,这一治疗领域将成为关注焦点。
FDA在孤儿药方面的快速审批与重视程度意味着,从商业角度来讲,投资罕见病的风险正在逐步降低,孤儿药的市场运作成为下一步需要重点考虑的问题。
基因疗法受FDA重视
除了对罕见病患者的倾斜以外,FDA去年在基因疗法、RNAi疗法和不限癌种的精准疗法上也均通过了新药审批。尽管基因疗法这样基于核酸编辑的新技术目前在市场上仅占极少份额,但FDA对其表示了极高的关注度,将其视为医药行业的风口之一。
早在2018年,FDA便明确表示将继续大力推进基因疗法的开发,并发布6大新指南,作为全面监管框架的基石,确保新产品符合FDA的安全性和有效性金标准。包括《治疗血友病的基因疗法产品的新指南草案》《视网膜疾病的人类基因疗法指南》《罕见病的人类基因疗法指南》《人类基因疗法新药申请(INDs)的化学、制造和控制(CMC)信息》《在产品制造和患者随访期间,测试逆转录病毒载体基因治疗产品具有复制能力的逆转录病毒》和《人类基因治疗产品给药后的长期随访》。
FDA希望,基于这些指南基因疗法能得到快速发展,从而促进该领域更多安全有效的创新产品进入市场,为应对难治性疾病带来希望。
而根据Vantage的分析,有关基因治疗的临床试验项目叫停数量正在快速增加,从2017年的1个增至2018年的4个,再到2019年的8个。这不仅反映了基于这种新技术的临床研究工作正在增加,也直观反映出FDA正在密切关注并把握该领域动向。
去年,FDA批准了诺华的脊髓型肌萎缩症(SMA)的基因疗法Zolgensma,该药定价210万美元,成为全球最昂贵药物。
而在Zolgensma之前,2017年 FDA批准过两项CAR-T细胞疗法,分别是治疗视网膜突变的Luxturna和治疗白血病的Kymriah,售价分别为 85万美元和54万~80万美元。
基因/细胞疗法作为新的治疗技术,其获批无论对相关疾病的治疗思路,还是对医药行业技术革新都有着重要意义,但是距离临床上广泛推广还有很长的路要走。其昂贵的费用是主要的争议焦点,不少声音认为,如果一种药物贵到没人能负担起,就失去了原本的用处。
然而,相对于“一劳永逸”治疗SMA的Zolgensma,一些其他罕见病的疗法同样逼近天价。比如,囊肿性纤维化疗法由福泰制药主导市场,其新型囊性纤维化三联疗法Trikafta的价格为每年31万美元。因此,Zolgensma虽然是世界上最昂贵的单次付款药物,但是否是最昂贵的药物,也在业内受到讨论。
展望2020
最受关注的新药
预计将在2020年接受审评的新药中,最受关注的莫过于渤健(Biogen)的阿尔茨海默症(AD)药物Aducanumab,该药的开发过程充满波折。Aducanumab由渤健与卫材(Eisai)合作研发,之前在早期临床试验中显示可以减缓疾病进展并降低疾病生物学活性。然而,独立的数据监测委员会对相关数据进行全面分析后认为,aducanumab对于AD以及轻度AD痴呆引起的轻度认知功能损伤没有改善作用,很可能难以到达主要疗效终点。去年3月,渤健因此宣布终止Aducanumab的Ⅲ期临床验证。在宣布终止临床试验后,该公司对包含更多患者的数据集进行分析后有了新发现。于是渤健在去年10月宣布,在与FDA协商后,预计2020年初为Aducanumab提交上市申请。
另一个备受关注的药物是Intercept公司的奥贝胆酸(Ocaliva),虽然该药并非首创新药,但有望成为首个获得FDA批准的非酒精性脂肪性肝炎(NASH)药物,该治疗领域蕴藏着巨大的市场潜力。
此外,阿斯利康(AstraZeneca)的肾性贫血药物罗沙司他(roxadustat)也受到密切关注。有观点认为,该药填补了未被满足的临床需求,但其也存在安全性的疑虑。值得一提的是,罗沙司他已于2018年12月率先在中国获批上市。
从商业角度来看,第一三共制药(Daiichi Sankyo)和阿斯利康合作研发的靶向HER2的抗体药物偶联物(ADC)Enhertu可能是今年上市新药中最具市场潜力的,该药已于2019年年底获得FDA批准,根据EvaluatePharma预测,2024年其销售额可达24亿美元。
此外,诺华斥资94亿美元收购的降胆固醇PCSK9靶向RNAi治疗药物inclisiran可能会在今年内获批。该药是皮下给药,每年只需注射两次,其将为疲软的PCSK9抑制剂市场带来怎样的变化值得关注。
不过,随着全球新冠肺炎疫情愈发严重,FDA宣布将推迟外国医药、医疗设备以及食品的常规审查至4月份,除非是“紧急重大任务”,而FDA对新药的审评工作会否受到延迟影响也有待进一步观察。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






