“老药新用”弃什么留什么 新规带来新指向
发布时间:2020-03-18 15:59:13作者:本报特约撰稿 边界来源:医药经济报
2月25日,国务院应对新冠肺炎疫情联防联控机制科研攻关组印发《关于规范医疗机构开展新型冠状病毒肺炎药物治疗临床研究的通知》(以下简称“《通知》”)。
该《通知》主要针对“老药新用”开展抗新冠肺炎治疗的临床研究。那么,《通知》解答了哪些问题?应该如何评估项目的现实问题、未来趋势和市场走向?
考量一 入组难问题?哪些项目考虑放弃?
《通知》明确以下两点:
一是对相关临床研究活动进行了具体规定。开展临床研究的医学机构为县级以上地方卫生行政部门确定的新冠肺炎救治定点医院(包括方舱医院等)。开展相关药品临床研究的医院应当按照《医疗机构开展临床研究项目管理办法》的要求进行伦理审查、立项,按要求备案,并在医学研究登记备案信息系统上传有关信息。
二是拟开展临床研究的药品应为已上市药品,并且该药品在体外实验中对新冠病毒具有明确的抑制作用,或动物实验结果支持开展新冠肺炎治疗临床研究。
拟开展临床研究的药品需要审批才能进入临床研究阶段:先通过省级卫生和科技行政部门上报国务院新冠疫情“联防联控机制”科研攻关组组长单位科技部的办公厅,科研攻关组下设的药物研发专班组织专家组研讨并提出初步意见;推荐进入临床研究的,由国家卫健委科教司统一协调医疗机构承接临床研究任务。
根据中国临床试验注册中心报道的新型冠状病毒肺炎临床研究索引(更新至北京时间2020年2月27日凌晨00时00分)共纳入258个临床研究,包括抗艾滋病的药物,治感冒、流感的药,干扰素、糖皮质激素、各种中药(包括中药注射剂)、脐带血、干细胞等。
被业界诟病的是,如果很多没有体外实验证实安全有效的药物纷纷加入了新冠治疗的临床试验,那么本该有希望的药物就有可能因为缺乏病人等原因,难以达到理想的预期结果,因此对拟上临床的药品做筛选分析确定有效后再允许启动临床有其必要性。
随着确诊的数量下降,目前已经启动的临床研究可能面临入组困难、样本量不够,最终可能难以得到具有临床统计意义的结论。
鉴于目前已开展的临床研究已经较多,有报道称轻症患者80%有可能不会转化成重症患者,因此,一些机理不明确、临床应用中过往有较大副作用、会引起细胞风暴的药品应该考虑放弃。此外,如果新冠只是十年才出现一次的频率,那么新增适应症的未来市场收益存疑。
考量二 超说明书剂量新规?立项怎么做?
《通知》还明确,临床研究中的给药方法不超过现有药品说明书的用法用量,预期人体内药物浓度可以达到体外实验换算到人体的有效浓度。
以利巴韦林为例。第五版诊疗目录试行版原定利巴韦林剂量为:成人首剂4g,每日8小时一次,每次1.2g,或8mg/kg iv. 8小时一次。而利巴韦林的说明书为:口服1日0.8~1g,分3~4次服用;肌注或静脉滴注每日每千克体重10~15mg,分2次。第五版诊疗目录试行版的用法用量显然超过现有药品说明书的用法用量。
于是,经全国新型冠状病毒肺炎医疗救治专家组充分讨论,考虑到大剂量利巴韦林的安全性,第五版诊疗目录试行修订版将利巴韦林使用剂量调整为:成人500mg/次,每日2~3次静脉输注;口服药被剔除。
新药在上新冠治疗的临床试验前,补做一个动物实验确定药品的有效剂量范围和安全剂量范围是非常有必要的。“老药新用”的一个亮点,就是不良反应和副作用都有积累数据,突破已有的用法用量的确没有必要。因此,体外实验药物浓度在安全范围外的药品,不应作为候选药品。
考量三 伦理问题?真实世界研究?
药品临床研究合规性主要在伦理。医院要提供条件保障伦理委员会紧急独立开展伦理审查。医院根据需要可聘请独立于药品供应方、参与临床研究工作的医务人员和患者的数据安全监查委员会,委员会可以在临床研究结束之前定期对研究进展情况进行评判。
如发现试验组有明显的毒副作用,或者无明确的治疗效果,立即向医疗机构报告,医疗机构提前终止研究,并及时上报联防联控机制科研攻关组;对疗效明确的,则应促进药品尽快推广使用,以尽快使更多患者受益。对未设独立的数据安全监查委员会的,医疗机构要随时关注药物可能的毒副作用,如有明显毒副作用或无明确治疗效果,应立即终止临床研究,切实保障受试者的权益。
有些产品由于没有通过伦理委员会批准,目前入组困难。例如PD-1单抗用于治疗新型冠状病毒肺炎(COVID-19)重型或危重型患者的临床对照研究,目前在中国临床试验注册中心的状态是该研究尚未获得伦理委员会批准,需要伦理委员会批准后才开始纳入参试者。
值得注意的是,有些中医药疗法选择了真实世界研究,例如“大剂量痰热清注射液治疗新型冠状病毒肺炎(COVID-19)真实世界临床研究”和“复方鱼腥草合剂预防新型冠状病毒肺炎(COVID-19)的真实世界研究”。
而真实世界研究需要专业的研究设计和数据分析跟踪和大数据,现在启动真实世界研究的包括广州中医药大学第一附属医院、上海市公共卫生临床中心、上海中医药大学附属岳阳中西医结合医院、南京中医药大学附属中西医结合医院等。这些医院需要考虑:是否能够积累足够的数据量作为真实世界的数据样本。
考量四 哪些项目有望进入新方案?
疗效好的药品有望进入诊疗方案。
根据《通知》,各级卫生和科技行政部门要及时收集辖区内相关药品临床研究进展情况,汇总临床研究结果,上报联防联控机制科研攻关组。联防联控机制科研攻关组组织药物研发专班统一汇总相关研究信息,初步审查后,将效果较好的药品推荐至联防联控机制医疗救治组(国家卫健委医政医管局),由医疗救治组组织专家研究决定是否扩大使用范围或纳入诊疗方案。疫情防控期间,由科研攻关组建立药品临床研究信息的统一发布机制。
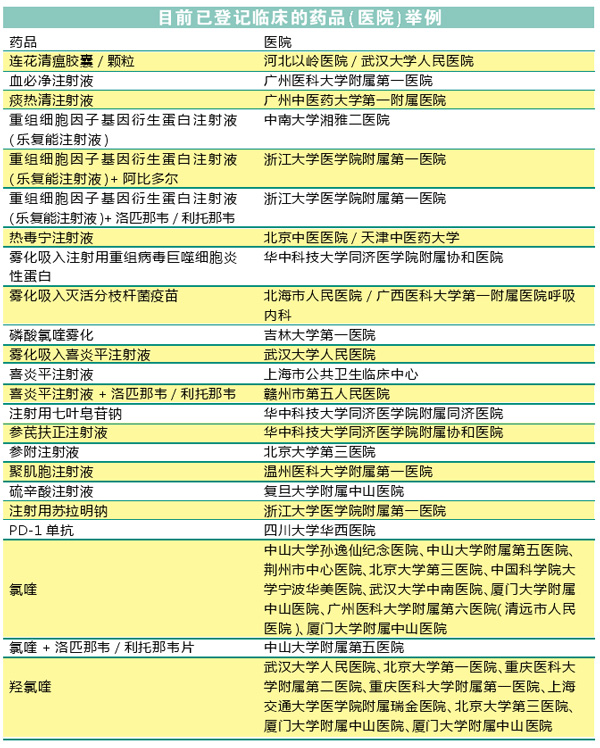
从目前已登记的药品临床研究来看,雾化吸入的产品包括雾化吸入注射用重组病毒巨噬细胞炎性蛋白、雾化吸入灭活分枝杆菌疫苗、磷酸氯喹雾化和雾化吸入喜炎平注射液四个产品,都属于超适应症使用,只有磷酸氯喹雾化吸入治疗暂未通过伦理。
联合用药也是目前的研究热点,洛匹那韦/利托那韦分别启动了干扰素-α2b、恩曲他滨(FTC)/丙酚替诺福韦(TAF)、重组细胞因子基因衍生蛋白注射液(乐复能注射液)、氯喹的联合用药。
中药注射剂方面,由于去年的西医不得处方中药、重点监控用药等政策,导致用量受限,“老药新用”给这类药品“复活”的机会。一些中药注射剂,此前或因出现严重过敏反应,或临床停用,或曾被要求更改说明书限制使用等,若能通过进入新冠诊疗变成“治疗用药物”,那么这些药品可能会以“战略储备”的身份回到药品采购和使用环节。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






