RNAi疗法步入收获期 后续研发线亮点抢先看
发布时间:2020-02-17 16:23:57作者:李项来源:医药经济报
RNAi疗法步入收获期
后续研发线亮点抢先看
随着2018年8月10日全球首个RNAi(RNA干扰)药物Onpattro(patisiran)获FDA上市批准,RNAi药物的时代终于到来。在过去20年里,由于剂量限制性毒性和治疗效果不足,RNAi候选药物开发屡屡受挫。
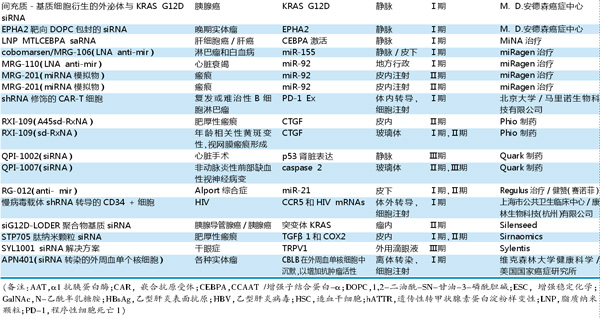
目前,针对肝脏、肾脏和眼部疾病适应症的多种RNAi候选药物已进入临床试验阶段,针对中枢神经系统(CNS)和非肝脏组织的其他研究性新药(IND)也将在未来2年进入临床研究。
未来,随着RNAi途径功能新发现,以及用于全身和局部RNAi递送方法等技术的改进,RNAi治疗将会实现新的突破。
首个RNAi药物技术探秘,走罕见病捷径
patisiran是由Alnylam公司开发的一种靶向转甲状腺素蛋白(transthyretin,TTR)siRNA疗法,被批准用于治疗遗传性转甲状腺素蛋白淀粉样变性(hATTR)。hATTR是一种罕见的危及生命的遗传性神经退行性疾病,由外周神经系统、心脏、胃肠道和其他器官中TTR淀粉样蛋白的沉积引起。患者具有进行性神经病变、心肌病、行走障碍和各种其他使人衰弱的症状,诊断后中位生存期为5~15年。
在patisiran及其反义核酸(ASO)药物竞争对手开发之前,该疾病的药物治疗选择局限于稳定TTR四聚体天然构象的小分子。尽管这些治疗方法可以减缓疾病进展,但临床非常需要更有效的治疗药物。
patisiran通过沉默肝细胞中的野生型和突变型TTR mRNA来降低TTR蛋白的血清水平。在技术上,patisiran是将siRNA包裹在脂质纳米颗粒(LNP)中,在输注治疗中将药物直接递送至肝脏,干扰异常形式TTR的RNA产生。通过阻止TTR的产生,patisiran可以帮助患者减少周围神经中淀粉样沉积物的积累。patisiran曾获得美国FDA授予的突破性疗法认定、优先审评资格、快速通道资格和孤儿药资格。patisiran的获批,对患者和医生来说,都具有里程碑的意义。
Alnylam公司在patisiran产品开发过程中,曾对两代LNP制剂ALN-TTR01和ALN-TTR02(patisiran)进行了临床中测试研究。ALN-TTR02是第二代聚乙二醇化LNP,比第一代产品ALN-TTR01体内效力提高10倍以上。Ⅲ期双盲安慰剂对照临床试验中,ALN-TTR02在控制hATTR进展方面具有令人印象深刻的安全性和有效性。
patisiran获得批准治疗多发性神经病变的hATTR,以及Onpattro的ASO竞争对手inotersen的批准,意味着一个新时代的到来。目前,这两种药物在超过18个月的持续治疗时间内的安全性和有效性仍不确定,并且还不知道是否对哪些特殊的患者亚群体更适合。因此,可能需要额外的试验和长期临床经验来对患者群体进行研究,以确定使用一种或两种药物为最佳治疗策略。
Alnylam遥遥领先,追赶者也有“大招”
目前处于临床试验阶段的RNAi药物中,大约三分之一是单分子化学修饰的RNAi触发剂。而RNAi药物递送的关键问题,正是开发具有足够代谢稳定性和效力的无毒RNAi触发剂。
Alnylam公司的Revusiran是第一款进入临床试验的代谢稳定的N-乙酰半乳糖胺(GalNAc)-siRNA结合物。与patisiran相似,revusiran靶向TTR mRNA用于治疗hATTR。在Ⅱ期临床试验中,皮下注射revusiran后,血清TTR水平平均降低55%~90%,而且副作用轻微,注射部位反应是最常见的不良事件,没有全身免疫激活现象。但是,2016年10月,revusiran的Ⅱ期开放标签延长期研究结果,报告有患者出现周围神经病变和血乳酸水平升高,此后停止开发。
尽管revusiran遭遇挫折,Alnylam仍继续开展GalNAc-siRNA结合物的临床开发。通过采用公司增强稳定化学(ESC)-半乳糖胺-RNA干扰共轭传递平台,siRNA制剂的RNAi效率显著提高。在revusiran停止开发后,Alnylam又宣布开发了两代siRNA ESC药物。在临床前和临床研究中,ESC不但使siRNA-GalNAc结合物疗效显著增加,而且明显降低给药剂量,进一步改善了药物毒性问题。Alnylam使用ESC技术的几款临床候选药物都取得了令人兴奋的结果,包括新的前蛋白转化酶枯草溶菌素9(PCSK9)抑制剂inclisiran,以及revusiran升级产品ALN-TTRsc02。
Ⅱ期临床试验发现,inclisiran与低密度脂蛋白(LDL)和PCSK9降低有关,接受两次Inclisiran300mg皮下注射治疗的患者LDL降低最为显著。
ALN-TTRsc02是用于治疗转甲状腺素蛋白(ATTR)淀粉样变性,去年分别获得EMA和FDA授予的孤儿药资格,并进入Ⅲ期临床研究。ALN-TTRsc02有望成为治疗ATTR淀粉样变性的每季一次、低容量的皮下注射RNAi药物。
2018年底,Alnylam还公布了用于急性肝性卟啉症患者givosiran的Ⅲ期ENVISION试验的中期分析结果,符合其主要疗效终点和许多次要目标。并根据6个月的研究结果启动了向FDA提交新药申请。
在RNAi领域,Alnylam无疑处于遥遥领先的地位。
不过,也有一些其他制药公司介入该领域,包括Arrowhead制药、Dicerna和Silence治疗公司。
Arrowhead制药公司开发了2款GalNAc结合物:ARO-HBV用于乙型肝炎感染和ARO-AAT用于与α1-抗胰蛋白酶(AAT)缺乏相关的肝病。临床试验表明,2款药物siRNA皮下注射给药后患者具有良好的耐受性,HBsAg(乙型肝炎表面抗原)和血清AAT水平分别显著降低。
类似地,Dicerna公司开发的1款GalNAc结合物DCR-PHXC公布了初步Ⅰ期临床试验数据,皮下注射给药后RNAi触发剂(基于专有的GalXC RNAi技术平台开发)通过沉默乳酸脱氢酶(草酸盐生产必需的酶)来治疗原发性高草酸尿症,结果显示24小时尿草酸盐降低至接近健康个体的水平。Dicerna公司计划开展该药物用于治疗乙型肝炎适应症的临床试验。
此外,Silence治疗公司开发的SLN124是一款靶向TMPRSS6的GalNAc-siRNA药物,用于治疗铁调节障碍,目前正在进行临床前开发。Dicerna还正在开发其他更新型的GalNAc结合物。
扩容——
探索非肝脏适应症
尽管目前临床开发的大多数RNAi候选药物都是以肝脏为目标,但RNAi疗法正在使用代谢稳定的siRNA进入其他组织。
Quark制药公司目前正在开发多款处于Ⅱ期和Ⅲ期临床试验中肾损伤和眼部疾病候选药物。QPI-1002是靶向TP53基因的siRNA,其通过静脉注射给药以预防心脏手术后的急性肾损伤和肾移植后肾功能恢复延迟(DGF),目前已进行Ⅲ期临床试验。QPI-1007是一款化学修饰的靶向caspase2的siRNA候选药物,用于治疗非动脉炎性前部缺血性视神经病变,Ⅰ期临床试验显示其对受试者视力保护的作用,已开始进行Ⅲ期临床试验。
此外,Alnylam最近报道了CNS靶向RNAi候选药物对非人类灵长类动物的临床前研究结果,并预计到2020年将提交IND申请。Alnylam还在开发新的靶向淀粉样蛋白前体蛋白(APP)药物用于治疗遗传性脑淀粉样血管病,通过腰椎穿刺注入脑脊液,有望成为CNS靶向药物的新递送方式。
Onpattro的批准,使RNAi疗法走向了临床实践。此外,基于GalNAc-siRNA结合物虽然仍处于临床开发阶段,但这些药物在不同肝脏适应症中都表现出良好的疗效和安全性,针对其他组织(如眼科、肾脏和CNS)的RNAi候选药物也取得了新进展。
目前许多RNAi临床候选药物是针对罕见疾病的。但是,Alnylam的PCSK9抑制剂inclisiran用于高脂血症,Quark的QP-1002用于肾脏损伤,PF-655用于湿性年龄相关性黄斑变性,如果获得批准,RNAi疗法可能用于更大的患者群体。

此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






