赴美上市新药必读 谁决定了临床研究成本高低?
发布时间:2020-02-17 16:13:49作者:廖联明 黄静来源:医药经济报
赴美上市新药必读
谁决定了临床研究成本高低?
美国食品和药物管理局(FDA)根据关键的临床试验来确定新药对特定疾病(适应症)的有效性和安全性。FDA必须对新药的益处是否超过风险进行评估。
自1962年以来,根据《食品、药品和化妆品法案》的要求,新分子要进行至少2个设计科学和对照合理的人体临床试验,才能够充分证明新药的有效性和试验结果的可重复性。
不过,《食品、药品和化妆品法案》也在一直完善中。修正案的补充规定增加了一些例外情况,如:有些新药的审批只需要提供1个大型临床试验的结果即可;加速审评的新药申请只需要提供单次临床试验的结果,而且允许用替代疗效指标来“合理”地预测治疗效果。
自2012年以来,对传统的新药审批标准又进行了许多改革。例如,在某些情况下,被指定为突破性治疗药物的新药可以没有对照组,而且可以提交中期疗效数据;或者应用病人富集策略,即选择最有可能受益的病人群体开展初步临床研究。
对2005-2012年FDA批准的188种新药涉及448个关键临床试验进行分析发现,临床试验的中位病人数为446名,48.9%的试验依赖于替代终点而非患者的临床获益,58项试验没有对照。Ⅲ期临床试验平均成本最低的是皮肤病药物,为1150万美元;平均成本最高的是止痛药和麻醉药,为5290万美元。大型心血管临床试验的情况有所不同,有专家通过数学模型估算出,病人数为14500和17000名时,成本分别为6700万美元和1.35亿美元。
那么,究竟哪些因素左右了临床试验的成本呢?
大数据
最近,乔治华盛顿大学公共卫生学院的托马斯·摩尔博士等人通过公开的数据和IQVIA CostPro数学模型,对2015-2016年美国上市新药的关键临床研究的成本进行了估算。他们还研究了这些试验中影响成本的因素。
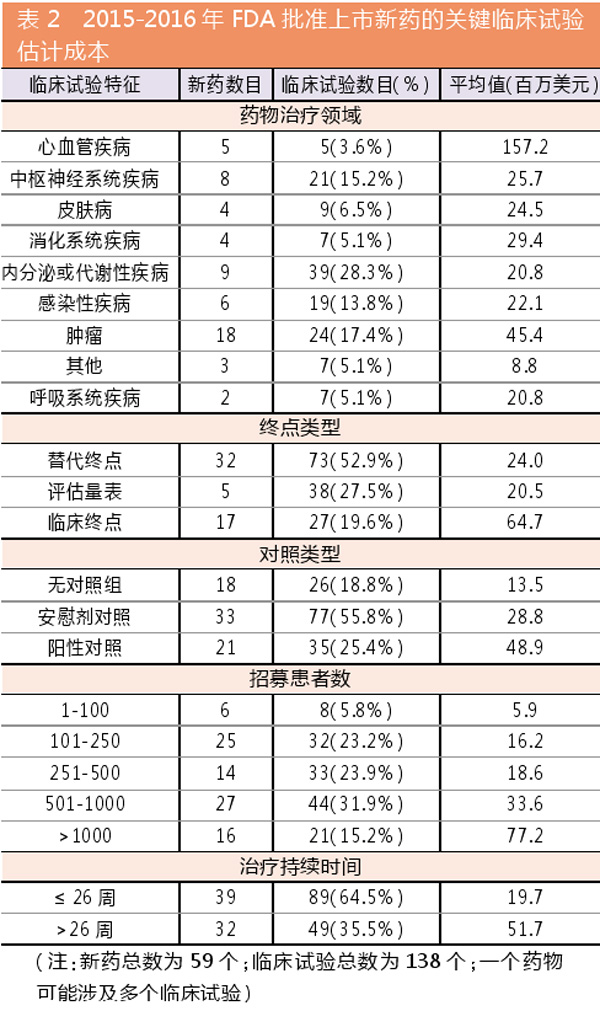
2015-2016年,FDA批准了59种新药,包括41种(69.5%)小分子药物和18种(30.5%)生物制品。主要适应症为癌症(18种,30.5%)、内分泌和代谢性疾病(9种,15.2%)和中枢神经系统疾病(8种,13.6%)。
超七成新药涉及快速审评
59个药品中,只有16种(27.1%)是按标准审批要求并完成了2项或以上的临床试验。其它43种药物(72.9%)被授予1种或多种形式的快速审评资格,或按照法定要求被豁免临床试验。
近半数新药为罕见病用药
此外,27种药物(45.8%)为治疗罕见疾新药。开发这些新药的公司依法获得政策上的优惠。
过半新药涉及多个适应症开发
这59种新药一共完成了138项关键临床试验。每种新药需要的关键临床试验数量差异很大:27个药物(45.8%)仅进行了1项临床试验,14个药物(23.7%)进行了2项临床试验,其余18个药物(30.5%)进行了3~11项关键试验。药厂进行2个以上关键临床试验的主要原因是他们希望开发更多的适应症,而每项适应症至少需要1个临床试验。
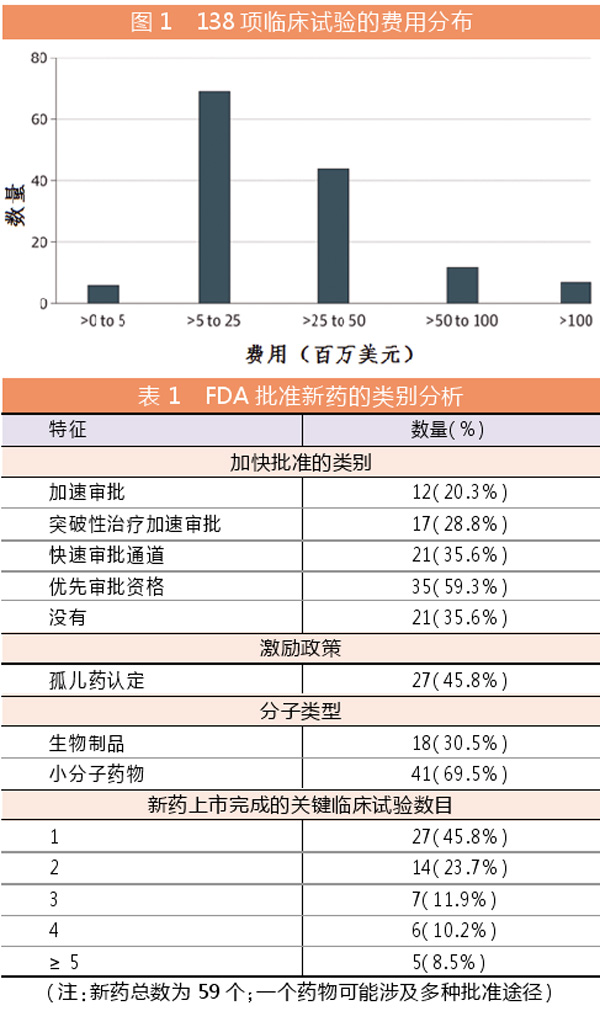
试验成本差距可超过100倍
总体而言,138项临床试验的估计中位成本为1900万美元。最低成本和最高成本的差异可以超过100倍。
成本最低的一项关键性试验估计花费了210万美元,该试验仅招募了4名患者,是关于三乙酸尿苷治疗罕见的遗传性代谢紊乱的乳清酸性尿酸尿症的研究。成本最高的试验是治疗慢性心力衰竭的新型心血管药物复方制剂(沙卡布曲/缬沙坦sacubitril/valsartan)的一项非劣效性试验,花费了3.648亿美元。试验终点为住院天数和心血管死亡率。此外,临床试验每位病人的成本中位值为4.1117万美元,每次随访的成本中位值为3562美元。
低成本的秘密
研究类型:无对照组、罕见病,成本低
138个试验中,有26个(18.8%)没有对照组,估计平均成本为1350万美元。有3项是针对罕见疾病的关键试验,平均费用不到500万美元。77项(55.8%)安慰剂对照试验的平均费用为2880万美元;35项阳性药物对照试验(25.4%)的平均费用为4890万美元。总的来说,112项对照试验(81.2%)的平均成本为3510万美元。
入组病人数:招募患者数越少,成本越低
关键性试验的中位病人数为488名,试验病人数差异很大。3种孤儿药(asfotase alfa,eteplirsen和triidine triacetate)的关键性试验招募的患者少于15名。有21项关键试验的患者数超过1000名。
试验的平均成本随着招募患者数的增加而增加。其中8项招募100名或更少的患者的试验,费用平均590万美元;而招募超过1000名患者的21项试验,平均成本达7720万美元。
治疗时间:治疗时间越短,成本越低
当研究中需要较长的疗程以验证药品的安全性或疗效时,成本会显著增加。
治疗持续时间为26周或更短的89项(64.5%)临床研究,估计成本为1970万美元;而治疗时间超过26周的49项临床研究,平均费用为5170万美元。
终点类型:用替代终点、临床量表,成本低
观察临床结局作为试验终点的研究与使用替代终点或临床量表的试验相比,其平均成本增加了一倍以上。使用临床终点的27项(19.6%)试验平均成本为6470万美元,而使用替代终点的73项试验(52.9%)平均成本为2400万美元。使用临床量表的38项试验(27.5%)平均成本为2050万美元,与采用替代终点的研究成本相近。
★★★ 总结 ★★★
总之,当新药只需采用非对照临床试验时成本最低。而当新药的临床疗效和目前公认具有显著临床疗效的药品相当时,其关键性试验的成本就极其高昂。
如用于治疗慢性心力衰竭的sacubitril-valsartan复方制剂,估计费用为3.4680亿美元。该非劣效性试验旨在证明与依那普利相比,其心血管死亡率和其他临床获益相近。而依那普利是标准的心衰治疗药物。
另一个例子是edoxaban用于治疗静脉血栓栓塞,估计平均费用为1.743亿美元。其成本高是因为与经典的抗凝血剂肝素和华法林相比,需要证明其有更大的临床获益和非劣效性。
需要指出的是,在大多数情况下,关键临床试验的实际成本比研究报告中估算的成本更高。因为第三方的成本估算往往不包括药厂承担的制造成本。不过研究发现,有显著临床益处的新药的关键临床试验成本其实并不高。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






