95个中美批准上市创新药 谁的盛宴?谁成就了盛宴?
发布时间:2020-01-23 01:14:53作者:本报特约撰稿 樊平来源:医药经济报
95个中美批准上市创新药
谁的盛宴?谁成就了盛宴?
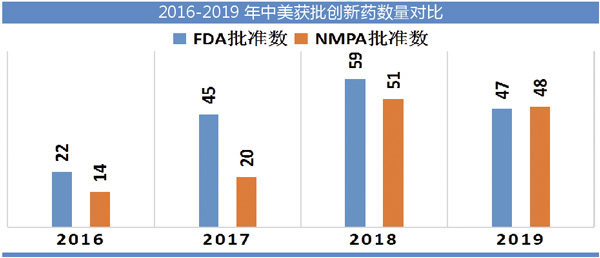
刚刚过去的2019年,从新药创新的角度又是丰收的一年。根据美国FDA及中国国家药监局(NMPA)数据,2019年美国及中国分别批准了47个和48个创新药物(含新分子实体、疫苗、新生物制品和创新中药,不含诊断试剂),合计95个品种获批,其中绝大多数品种在所涉及的治疗领域都将推动该疾病治疗的进展。尽管数量不及2018年,但也是近几年的一个高点。
FDA提速引擎
47个新药获得FDA批准,使得2019年成为继2018年以来获批创新药最多的一年。同时,2019年获批的药品不少都具有重大的临床价值,比如一些尚无可靠治疗手段的孤儿药,以及登革热、埃博拉病毒疫苗等可以挽救大量人群生命的疫苗产品。
2016年“21世纪治愈法案(21st Century Cures Act)”的通过,无疑大幅加快了美国药品审批的速度。该法案的核心是加快紧缺药物的批准,尤其是将部分原来普遍要求在上市前完成的临床验证或安全性试验移到上市后的真实世界研究中。2019年1月, FDA进一步更新了加速批准途径下的药品和生物制品标签指南,强调在批准加速审批流程后,药企可以在药品上市后完成研究,以确认该产品的优势。
另一个导致FDA新药批准数量快速提升的引擎是孤儿药策略。2019年FDA获批的品种近一半属于罕见病用药,针对极其小众的目标人群。从1983年美国颁布“孤儿药法案”起,至今已经批准了超过700个孤儿药,对于孤儿药,FDA往往都会通过加速审查、给予突破性认定以及授予孤儿药资格等方式为其广开绿灯,这也为罕见病人群带来了更多的希望。
中国跑出N个创新加速度
让我们将目光转回国内。国内48个新药获批数量虽然不及2018年,但关键的是国内企业申报上市的有13个品种,这说明国内药企在新药开发中的地位已经越来越高,以恒瑞和百济神州为代表的两类国内制药企业已经成为了国内药品自主创新的主要推动力量。
随着近几年药监部门对于药品审核积压的有效治理,药品审核速度明显加快,特别是《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》的出台,使得国外创新药有望同步在国内获批。2019年一系列新的政策法规的出台或者征求意见,让我们对中国的药品审批速度有了更高的期待。2019年12月1日新修订的《药品管理法》,法案明确对临床急需的短缺药、防治重大传染病和罕见病等疾病的新药、儿童用药开设绿色通道,优先审评审批。同时,对于治疗严重危及生命且尚无有效治疗手段的疾病,以及公共卫生方面急需的药品,临床试验已有数据显示疗效,并且能够预测临床价值的可以附条件审批,以提高临床急需药品的可及性。2019年11月CDE发布关于《突破性治疗药物工作程序》和《优先审评审批工作程序》征求意见,这可以算是中国版的Breakthrough和Priority review。在此背景下,作为国家认定的临床短缺药,阿帕他胺2019年仅用了6个月就完成了NMPA的审批。另一方面,在国家新药创制政策的培育和辅导下,中国新药自主研发水平日新月异。2019年百济神州的泽布替尼在FDA获批标志着中国创新药已经首次得到了FDA的认同,这无疑将进一步鼓舞国内的创新企业。
孤儿药盛宴
2019年美国和中国分别获批了18个和7个孤儿药,两国累计获批了25个罕见病用药。
美国是罕见病政策最为完善和成熟的国家,对罕见病有相关立法、成熟的国家计划以及罕见病用药特批政策。美国国家罕见病组织(NORD)成为推动罕见病药物研发及使用的最重要机构,在该患者组织的影响下,美国给予罕见病药物开发机构一系列支持,包括独家经营权、财政支持,同时孤儿药全面纳入医疗保障体系。
2019年FDA批准的18个罕见病用药中,有不少对该疾病的治疗带来了突破性提升。
其中,Celgene的Reblozyl(Luspatercept)适应症是β珠蛋白生成障碍贫血,属于临床上较为常见的溶血性贫血,疾病原因是珠蛋白基因缺陷导致珠蛋白肽链合成障碍。输血目前是重症珠蛋白生成障碍贫血的唯一可靠方案,但长期大量输血不管从经济性还是可及性角度都存在问题,Reblozyl 作为红细胞成熟剂可促进晚期红细胞的成熟,提高血红蛋白水平,从而减少输血量及频次。作为数十年来首个获批的地贫用药,市场研究机构预测Reblozyl年销售额有望达到20亿~30亿美元。
另一个亮点是获得性血栓性血小板减少性紫癜用药Cablivi(Caplacizumab)。Cablivi是全球第一个上市的纳米单抗,而单抗的小型化一直是研究的一个方向,由于纳米单抗分子量小,有更低的免疫原性风险和更高的穿透性,这为抗体药物研发提供了新的路线。
中国的罕见病领域目前最主要的问题依然是药物短缺,2018年国务院专项会议就强调要对1900万患者给予更高度的关注。此后国家卫健委牵头成立了国家罕见病诊疗协作网,也出台了中国首批罕见病目录,此外一些地区如浙江已经将罕见病纳入大病保障体系降低患者家庭的负担。另一方面,尽管国家加快了孤儿药开发的支持力度,但目前中国新上市的罕见病药物依然基本为跨国企业的产品。2019年强生的兆珂(达雷妥尤单抗)在中国获批用于多发性骨髓瘤的三线用药,该药是首个获批的CD38单抗。从产品名称可以看出,强生期待兆珂成为万珂(硼替佐米)的替代和升级品,鉴于2019年FDA已经进一步批准兆珂一线治疗多发性骨髓瘤的适应症,故该产品的市场值得期待。
(预告:对于大众而言,七类创新药将显著提升临床治疗水平和改变药物市场格局。本报将随后刊出,敬请关注!)
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






