一直在鼓励,为何不跟随?
发布时间:2020-01-22 15:33:51作者:本报特约撰稿 边界来源:医药经济报
一直在鼓励,为何不跟随?
2019年是药品企业面临政策改革挑战压力非常大的一年,大多数企业都是跟着政策跑。逐利驱动下,哪个政策所带来的利益越大,企业的拥挤度越高。然而实践证明,在政策颁布之初,特别是各部门之间的支持政策不到位之前,企业是难以正确预判政策对企业利好度的。
做政策跟随者?
风险大!
譬如仿制药一致性评价的政策,当年药监局鼓励企业积极布局仿制药一致性评价特别是基本药物289目录,曾经提出超过3家企业获批一致性评价的产品将有机会瓜分专利过期原研药市场,未通过一致性评价的企业将不得进入医院采购市场。这让许多当时用量较大,并且由于专利过期原研药品价格相对较高从而导致整体市场规模较大的产品成为国内企业仿制热门产品,例如氨氯地平、恩替卡韦、瑞舒伐他汀等。
2017年最后一天,国内第一个通过仿制药一致性评价的产品获批,2018年医保局启动“4+7”仿制药带量采购,最低价中标。2019年医保局将“4+7”扩面到联盟省份采购,中标规则变为3家中标。2020年预计开始采取第二批药品目录的带量采购,中标规则改为“N-1”中标,但最多不得超过6家同时中标。
参与竞争企业数的不确定性,以及政策的不确定性,导致第一批参与的企业价格呈现两极分化——竞争激烈的产品利润非常低;三家以内竞争相对不充分的产品则能维持一个相对较好的价格,并且能够瓜分到不错的市场。
由此可见,当政策面大家都认为利好的时候,政策跟随者数量一旦过多,该产品很有可能就会因为同质化竞争而发生悲剧。
儿童药上市申报?
遇冷!
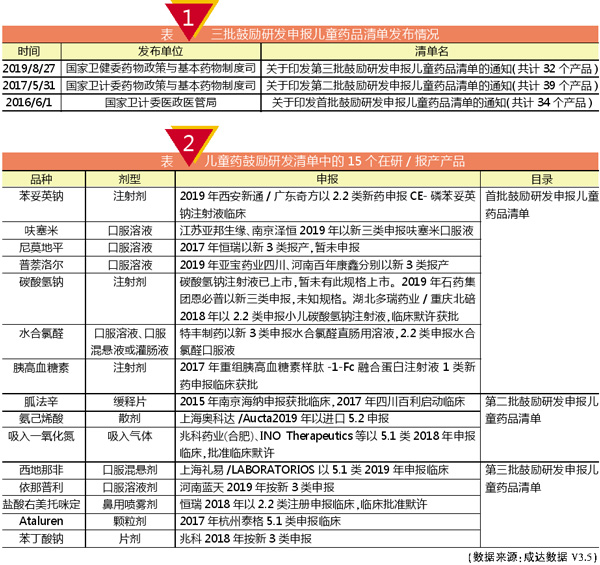
2016-2019年,国家卫健委相关部门共计发布了三批鼓励研发申报儿童药品清单,涉及105个药品,这些产品是为了促进儿童适宜品种、剂型、规格的研发创制和申报审评,满足儿科临床用药需求,围绕我国儿童疾病谱以及相关企业研发生产能力制定的。
这三批鼓励研发申报儿童药品清单包括国内已上市和未上市的儿童药品,所鼓励的药品分类包括创新药、改良药和仿制药,甚至还包括了生物制品。
只上市两个药
从2016-2019年,105个清单产品仅2个产品成功上市。这两个产品都是仿制药。
一是咪达唑仑口腔黏膜溶液,2018年吉林津升以新3类报产,2019年该企业此产品共4个规格获批上市。此外,2019年人福申报咪达唑仑口服液。
其次是左乙拉西坦的注射剂,2014年申报以旧3.3类申报的成都天台山产品2018年获批,河北仁合益康2017年以新4类申报2019年获批。
这两个产品都来自于2016年6月公布的首批鼓励研发申报儿童药品清单,从鼓励名单到获批共花了接近3年的时间。
15个在研/报产产品
105个产品中,共有15个产品在2017年以后以新注册方法申报或启动临床研究项目。其中,有以进口新药引进,如西地那非的口服混悬液、吸入一氧化氮;也有改良型项目,如特丰制药以新2.2类申报水合氯醛口服液,恒瑞以新2.2类申报盐酸右美托咪定鼻用喷雾剂;甚至也有仿制药进口项目,例如上海奥科达/Aucta在2019年以进口5.2申报氨己烯酸散剂。
儿童药政策利好?
实质性利好没那么大!
儿童用药目录的产品申报,就像新政策未明朗下的探索者。
首先,虽然在各大政策上都提及扶持儿童用药,但是,除了优先审评之外,儿童用药并没有其他政策扶持。
其次,卫健委制定的儿童用药目录也好,仿制药鼓励研发用药目录也好,从发布的表格中看不到足够的临床意义和立项思维支撑。首批鼓励研发申报儿童药品清单中,不少产品是来自289基本药品目录的口服制剂改口服溶液的,这些产品市场规模并不大。对于改良型新药来说,当需要做的临床研究成本很大,而临床意义不足以推动研发成本时,企业通常会选择放弃。
改良型新药方面,儿童药物的上市都需要做大批量的临床。例如恒瑞的2.2类新药盐酸右美托咪定鼻喷剂,2017年针对成人药代动力学/药效动力学研究分别48例,2018年和2019年用于成人全身麻醉手术患者镇静的有效性和安全性多中心、随机、双盲、安慰剂对照临床试验292例和32例。2019年才开展针对儿童患者评价盐酸右美托咪定鼻喷剂用于儿童术前镇静的群体药动学特征(PPK)和儿童术前镇静的有效性及安全性患者48例。由此可见,儿童的改良剂型要开展的临床研究,依然是要按药品上市最严标准开展。
仿制药同样如此。例如胍法辛缓释片,2017年四川百利启动260例盐酸胍法辛缓释片治疗儿童及青少年注意缺陷多动障碍(ADHD)有效性与安全性的随机双盲安慰剂平行对照多中心研究至今仍未完成,2018年启动的针对健康成人的药代动力学和安全性研究早已完成,这与ADHD患儿较难入组也有一定相关性。
上述的临床开展情况表明,儿童用药的利好仅仅只是注册审批过程的加快,暂时没有别的实质性的利好政策,但产品一旦上市可能会享有较长的独占期。然而,投入时间长、风险高、回报周期不确定,正是卫健委从临床需求出发的目录响应者平平的主要原因。
也许某些CRO的项目被有幸选中了,但企业综合市场上的项目评估,最终能成交的可能性非常小。企业投入新项目,最差的收获是得到相关适应症的临床数据积累,为未来上市甚至成为治疗标准的制定者打好基础。但是,这种积累毕竟不能短时间转化为利润,并不是所有企业都有意愿投资,特别是企业的温饱还没有解决、产品线储备还缺乏的时候。
★★★ 总结 ★★★
医药市场往往被认为是政策市场。究竟选择“跟随政策”还是“利用政策”,其实要从企业的自身能力出发。
2020年,不少药品企业可能已经没有多少研发费用,只能孤注一掷到一个项目上,那么选择怎样的项目才是最好呢?如果没有能够执行到位的研发团队保证项目落地,有时找靠谱的合作伙伴“众筹”一个可靠的项目可能更实在。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






