改规格改剂型立项怎么选? 参比制剂新趋势找答案
发布时间:2020-01-20 11:57:34作者:本报特约撰稿 边界来源:医药经济报
新年伊始,研发立项相关政策又有新动向,聚焦于仿制参比制剂,连出四个公告。
2020年1月7日,国家药监局发布仿制药参比制剂目录(第二十三批) (2020年第4号)和仿制药参比制剂目录(第二十四批) (2020年第5号)的通告。1月10日,CDE发布化学仿制药参比制剂目录(第二十五批)(征求意见稿)和化学仿制药参比制剂目录(第二十六批)(征求意见稿)。
值得注意的是,在仿制药参比制剂目录(第二十五批征求意见稿)和化学仿制药参比制剂目录(第二十六批征求意见稿)中,CDE首次公布了《未通过审议的参比制剂品种目录》合计29个。
“未通过”四大原因
笔者总结未通过审议的参比制剂品种目录主要有以下四大原因:
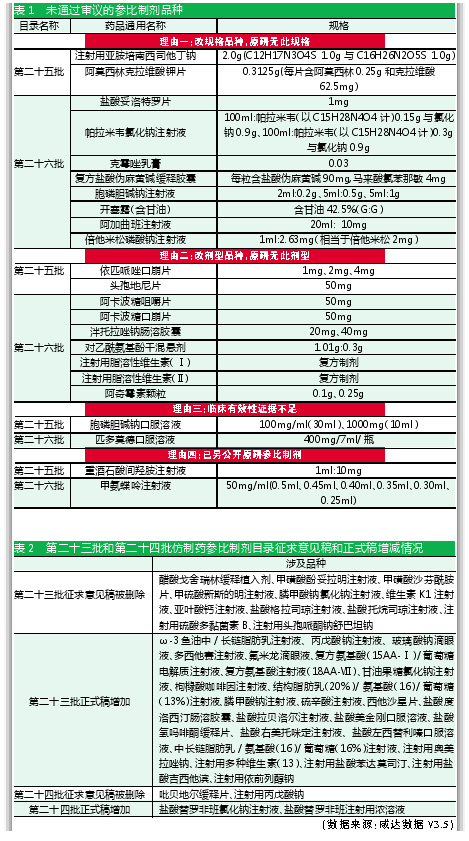
1.改规格品种,原研无此规格
例如阿加曲班注射液,国内上市的原研厂家规格是田边三菱的2ml:10mg。原研药曾于2002年在日本上市10mg/20ml规格,但原研药在日本已退市此规格,目前仅有仿制药在销售10mg/20ml规格,特别是中国已上市的仿制药,都是此规格。第二十六批征求意见稿还推荐了美国已上市的50mg/50ml(1mg/ml)作为参比制剂。由此可见,原研药已经退市的规格不能成为参比制剂。
2.改剂型品种,原研无此剂型
以阿卡波糖为例,原研药为阿卡波糖片。国内已上市的咀嚼片,以及国外已上市的改良药阿卡波糖口崩片都没有成为参比制剂。
3.临床有效性证据不足
以胞磷胆碱为例,胞磷胆碱钠口服溶液在化学仿制药参比制剂目录(第二十五批征求意见稿)中被认为是“经一致性评价专家委员会审议,本品临床有效性证据不足”。但是,胞磷胆碱钠注射液4ml:1g(以胞磷胆碱计)和4ml:500mg(以胞磷胆碱计)规格在欧盟上市的被列进化学仿制药参比制剂目录(第二十六批征求意见稿),胞磷胆碱钠注射液的2ml:0.2g、5ml:0.5g和5ml:1g却因为“经一致性评价专家委员会审议,本品为改规格品种,原研无此规格”而没有成为参比制剂。
匹多莫德口服溶液参比制剂未通过审议,是因为“经一致性评价专家委员会审议,根据《总局关于匹多莫德口服液启动临床有效性试验的通知》食药监药化管函(2018)31号,本品临床有效性证据不足”。食药监药化管函(2018)31号主要要求匹多莫德口服液(注册证号:H20150635)公司POLICHEM S.R.L按照《中华人民共和国药品管理法》的有关规定,尽快启动临床有效性试验,并于3年内将评价结果报国家食品药品监督管理总局药品审评中心。2019年,普利化学工业公司/POLICHEM S.R.L.多帕药业有限公司启动了研究匹多莫德在儿童呼吸道感染中的有效性和安全性的临床试验,适应症为“用于慢性或反复发作的呼吸道感染的辅助治疗”,预计入组数334人。
值得注意的是,匹多莫德颗粒曾在2017年10月进入了仿制药参比制剂目录(第十批)》,无需启动临床有效性试验,但暂未有国内已上市厂家申报一致性评价。
4.已另公开原研参比制剂
甲氨蝶呤注射液在第二十四批参比制剂目录中已公布的是根据美国橙皮书,持证商为HOSPIRA INC。
重酒石酸间羟胺注射液在化学仿制药参比制剂目录(第二十五批征求意见稿)推荐了澳大利亚上市的原研厂家,非推荐的厂家在同一意见稿以“经一致性评价专家委员会审议,推荐了在澳大利亚上市的原研品作为参比制剂”为由未进入参比制剂目录。
参比制剂上市国家为澳大利亚的产品中,重酒石酸间羟胺注射液不是第一个,阿司匹林肠溶胶囊、盐酸氯丙嗪片、福辛普利钠片和美洛昔康胶囊上市国家都为澳大利亚,但产地未必是澳大利亚的产品。
有哪些“补录”机会
第二十三批和第二十四批的征求意见稿和正式稿,都有产品增加或者剔除。例如醋酸戈舍瑞林缓释植入剂就没有进入第二十三批的正式目录。
1.“未通过”未必都是“问题品种”
被删除的产品有可能是因为重复。例如吡贝地尔缓释片的“原研进口”模式进入征求意见稿,正式稿收录的是国内上市的原研药品,第二十四批征求意见稿欲同时收录“原研进口”和“国内上市的原研药品”两种模式,但最终没有获批。
2.对征求意见稿“补录”
增加的产品有的是此前的征求意见稿没有进入目录的。例如丙戊酸钠注射液有两个厂家进入了第二十二批征求意见稿,第二十二批正式稿只收录了赛诺菲一家企业产品,第二十三批则增加了Desitin Medicines GmbH。
盐酸格拉司琼注射液在第二十二批目录中收录了原研药国内撤市、推荐美国上市的国际公认的同种药品Granisetron Hydrochloride injection的1mg/1ml规格产品;然而,第二十三批同厂家在欧盟上市的3mg/3ml则不予批准。第二十六批该产品同厂家同规格又申报了一次参比制剂目录,暂未知能否正式获批。
3.同通用名同剂型同类产品有机会“补录”
同通用名同剂型产品进入了征求意见稿目录和正式稿目录,其他同类产品也可能被收录进正式稿目录。例如第二十四批征求意见稿收录了盐酸替罗非班注射液,正式稿除了收录盐酸替罗非班注射液,还收录了盐酸替罗非班注射用浓溶液和盐酸替罗非班氯化钠注射液。
★★★ 小结 ★★★
改剂型、改规格类产品如何选择参比制剂一直以来都是业界的“未解之谜”。第二十五批和第二十六批参比制剂的征求意见稿公布的结果,明确了非原研厂家的改剂型改规格产品成为参比制剂的可能性非常小。这意味着这类产品的仿制或者进口引进都必须选择原研已有的剂型和规格作为参比制剂;这类药品首次在国内进口预计也不得以“5.1类”申报,而只能以“5.2类”申报。
企业做改剂型改规格的产品引进项目,也要做好项目资料的审核。如果项目选择了国内不认可的参比制剂,很有可能导致整个项目都要重新研究。
值得注意的是,安全无效或者处于辅助用药位置的药品可能因为临床有效性证据不足而没有参比制剂,这意味着此类药品除非原研药在国内补了临床有效性试验,否则不得仿制。
另一方面,已仿制的产品不能启动一致性评价,但同样因为没有竞争对手加入竞争从而可以相对享受“长尾效应”的市场。这类产品也没有批文退出市场的时间限制,在被踢出各省医保增补目录以前还会享受到较好的市场规模。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






