诺华成2019年新药赢家
发布时间:2020-01-20 09:57:40作者:综合编译/廖联明来源:医药经济报
根据FDA统计,2019年其药品评价与研究中心(CDER)批准了48个新分子实体,低于2018年的59个,而2017年、2016年分别是46个、22个。“近十年美国新药获批的情况显示了数字是如何攀升的。”Vantage网站一份最新报告指出:“FDA非常关注罕见疾病或抗肿瘤领域中发病率较低的病种,这些药物通常能以非常迅速的审评速度通关。”
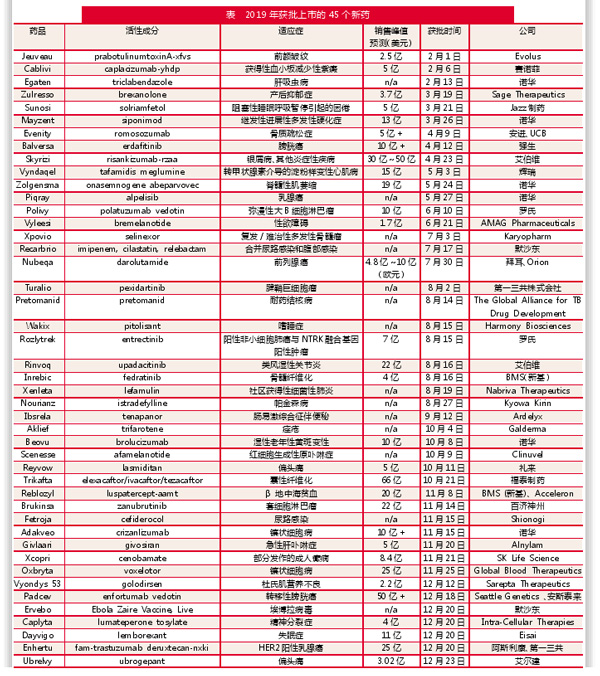
FiercePharma对2019年FDA批准的45个新药进行了梳理。需注意的是,其剔除了CDER批准的1种用于眼科手术的染料、1种铁麦芽醇补铁剂Accuffer和3种诊断性显像剂,但纳入了生物制品评价与研究中心(CBER)批准的诺华(Novartis)脊髓性肌萎缩症(SMA)基因疗法Zolgensma,以及默沙东(Merck)的埃博拉疫苗。
治疗领域:抗癌药仍最热
从企业获批新药数量来看,诺华成为2019年的大赢家。算上Zolgensma,该公司有6个新药获批。与2018年新药获批数最多的辉瑞(Pfizer)不同,后者获批的4个新药全为抗肿瘤药,而诺华的新药涉及多个疾病领域:乳腺癌药物Piqray、多发性硬化症药物Mayzent、镰状细胞药物Adakveo、治疗湿龄性黄斑变性的Beovu,以及用于治疗肝吸虫的Egaten。
其余大部分药企基本仅有一个新药获批,而罗氏(Roche)、默沙东、第一三共(Daiichi Sankyo)与艾伯维(AbbVie)等少数公司分别获批了两个新药。其中,值得关注的是百时美施贵宝(Bristol Myers Squibb),该公司结束了长达两年的新药空白期。BMS以740亿美元收购新药(Celgene)的交易开始有所收获,其获批的两个新药都是在这笔交易中获得的血液病新药:骨髓纤维化药物Inrebic和治疗β地中海贫血的Reblozyl。
回顾过去,BMS是2017年和2018年唯一一家未有新药获批的前15大制药公司。而2019年,葛兰素史克(GlaxoSmithKline)、吉利德(Gilead)与梯瓦(Teva)加入了这一阵营。如果不是在最后时刻(2019年12月24日)与第一三共合作的乳腺癌药物Enhertu获批,阿斯利康(AstraZeneca)也会“挂零”。
从获批的新药来看,Sarepta公司治疗杜氏肌营养不良症(DMD)的药物Vyondys 53是最具争议的新药,在被FDA拒绝4个月后,该药最后又出人意料地获得了上市批准。这是继2016年Sarepta获批的Exondys 51和2017年Marathon Pharma公司获批的Emflaza之后的又一个DMD新药。
从新药的治疗领域来看,与往年一样,抗癌新药占比最高,一共有11个,实体瘤新药和血液肿瘤新药分别是7个和4个。强生(Johnson & Johnson)2019年唯一获批的新药Balversa是膀胱癌的首个靶向治疗药物;西雅图遗传学公司(Seattle Genetics)与安斯泰来(Astellas)的Padcev(一种治疗转移性膀胱癌的抗体药物结合物)提前获批;罗氏的Rozlytrek也是“和组织类型无关”的抗癌药,与拜耳(Bayer)和Loxo公司(现在是礼来的子公司)的Vitrakvi属于同一类药物,其被批准用与Vitrakvi相同的携带NTRK融合基因的肿瘤,以及ROS1阳性的非小细胞肺癌。
在血液肿瘤新药方面,BMS的Inrebic获批作为骨髓纤维化的一线和后续治疗,骨髓纤维化是一种罕见癌症,患者由于纤维化骨髓无法产生健康的血细胞;罗氏的Polivy和百济神州的Brukinsa都获批用于治疗淋巴瘤,后者成为中国本土研发的首个获得FDA批准的药物;在经历了一段波折后,Karyopharm公司的Xpovio终于通关,被批准用于治疗多种治疗无效的多发性骨髓瘤患者。
紧随其后的是中枢神经系统疾病治疗领域,有7种新药上市,包括AMAG公司用于治疗性欲障碍的Vyleesi,SK生命科学公司的抗癫痫药物Xcopri,以及礼来与艾尔建(Allergan)的两个偏头痛药物等。Sage公司的Zulresso成为第一个获得FDA批准的产后抑郁症治疗新药,IntraCellular公司的精神分裂症新药Caplyta经过漫长的等待后也终于获批。
接着就是罕见病药物和抗生素,各有4个新药获批。两种类型的卟啉症分别有新药获批:Alnylam公司的Givlaari和Clinuvel公司的Scenesse;而转甲状腺素介导的淀粉样变(ATTR)有了第3种新药——辉瑞的Vyndaqel,虽然该药比Alnylam公司的Onpattro和Ionis公司的Tegsedi晚进入市场,但其获批的是ATTR的另外一个亚型。
在传染病领域值得关注的新药有:非营利组织全球结核病药物开发联盟(Global Alliance for TB Drug Development)开发的、用于联合治疗耐药结核病的Pretomanid;Nabriva公司带来了一种新型抗生素Xenleta,这是截短侧耳素药物中的第一个上市产品,其针对的蛋白质合成结合位点与以前的抗生素不同。
审评速度:标准宽松引担忧
对于近几年新药数量稳定保持在高位的态势,新英格兰咨询集团(New England Consulting Group)执行合伙人史蒂芬·罗宾斯(Steven Robins)指出,每年药品获批数量的起伏取决于新技术的成熟程度,当一家走在前列的公司发现了一项新技术或新的作用机制,其他已进入该领域的公司就会参与竞争,开发类似的产品。而也有人认为,新药数目总体上升趋势是FDA“更友好”的结果。
Vantage报告指出:“FDA的快速审批将原来可能在2020年上市的几个重磅新药的获批时间提前到2019年。”福泰制药(Vertex)最新的囊性纤维化治疗药物Trikafta在递交上市申请后3个月,比其PDUFA日期提前5个月获批。全球血液疗法公司(Global Blood Therapeutics)的镰状细胞新药Oxbryta也提前3个月获批。这些快速批准的新药可能是一个信号,表明FDA正在让比现有药物稍好一点的新药上市。
“有人对过度使用加速审批通道和缺乏对上市后验证性研究的监督感到担忧。例如,开发昂贵的新药,而这些新药和现有药物相比疗效几乎没有改善,这对患者来说不是好事。”Vantage报告指出。2020年几个新药上市申请的审批决定,将有助于进一步看清FDA新药审评的松紧程度,其中包括渤健(Biogen)的阿尔茨海默病新药aducanumab,在Ⅲ期试验获得无效性分析后,该药近乎被放弃,但其后渤健表示计划2020年年初向FDA提交aducanumab的上市申请。
罗宾斯认为,至少在近期药品批准数量将相当稳定,“每年都会有一小部分真正创新的新药,然后就会有很多类似的新药加速出现,类似的新药在第一个创新药上市1~3年后将大量上市。”
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






