中美上市硕果累累 这些新药颠覆市场格局
发布时间:2020-01-19 14:31:03作者:本报特约撰稿 樊平来源:医药经济报
2019年,中美共95个创新药获批(含新分子实体、疫苗、新生物制品和创新中药,不含诊断试剂),绝大多数品种在所涉及的治疗领域都将推动该疾病治疗的进展。那么,对于大众而言,哪些创新药品种更具临床价值及市场前景呢?笔者总结出七类将显著提升临床治疗水平和改变药物市场格局的创新药。
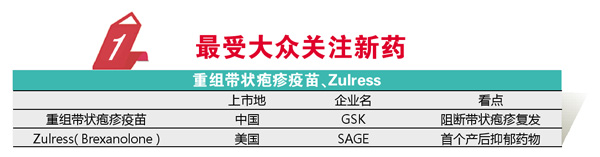
每年都有一些覆盖较大目标人群的突破性药物获批,这些产品的获批无疑最受大众关注。
带状疱疹是一个困扰大量人群的疾病,《2018年带状疱疹中国专家共识》指出该病中国年发病率超过3‰,并逐年递增。复发及带状疱疹后神经痛是带状疱疹治疗最大的问题,但对此却一直缺乏有效的防控策略。2017年FDA批准了GSK的Shingrix(重组带状疱疹疫苗),该药可以阻断90%的患者人群复发,这无疑让带状疱疹患者欢欣鼓舞。与宫颈癌疫苗不同,该药2019年在中国快速获批上市。
产妇是抑郁的高发人群。有报道称,抑郁状态会困扰超半数的产妇,而其中1/9属于中重度抑郁需要进行长期服用抗抑郁药进行干预,但考虑到该患者群体的特殊情况,包括“五朵金花”在内的抗抑郁药并不适用于大部分该类患者。2019年FDA首次批准了用于产后抑郁的药物,SAGE的Zulresso(Brexanolone)。Zulresso作为GABAa受体调节剂,连续静脉注射该药60小时后,患者汉密尔顿抑郁量表评分可以快速降低,这为重度产后抑郁患者带来了希望。
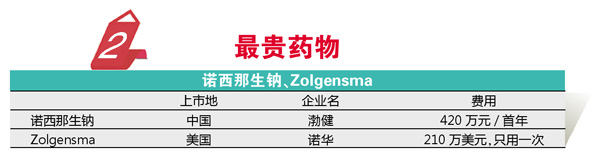
药物研发的创新为诸多疑难疾病治疗带来巨大突破的同时,也催生出一系列天价药物。2019年中美都批准了一个这样的品种,适应症都是一种重症基因缺陷性疾病——SMA(脊髓性肌萎缩症)。渤健(Biogen)的诺西那生钠注射液是全球首个获批用于SMA的靶向药物,于2016年获得FDA的批准。诺西那生钠通过RNA技术,可以改变变异基因生产的蛋白,从而使SMA患者表达正常的运动神经元存活蛋白。2019年诺西那生钠注射液在中国获批,并已经成功在国内缓解了一部分重症SMA患儿的病情,但鉴于技术的复杂性,尤其是患者基数太低,产品价格极其高昂,患者第一年需要使用6支该药,年用药费用高达420万元,即便厂家提供了患者援助计划,但对于大多数患者家庭而言,国家层面的救助或者医疗保障也许更为关键。
2019年诺华上市的SMA药物Zolgensma(Onasemnogene abeparvovec)的定价无疑更令人咋舌,210万美元的价格应该是迄今为止最昂贵的药物。与诺西那生钠不同,该药仅需注射一次,即可通过AAV9病毒将正常表达SMN蛋白的转基因导入患者修复患者突变基因,从而从根本上治疗SMA,可见贵确实有贵的道理。不过,不久前Zolgensma被爆出其临床前数据存疑的消息,还是对其未来带来了一些隐忧,希望这些数据不会影响到产品的临床效果。
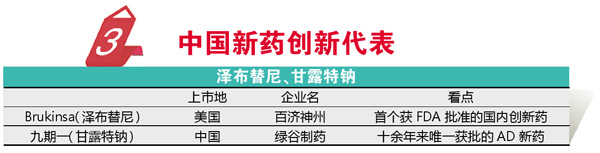
中国的新药创新水平正一步步向欧美靠拢,2019年中国新药的最大新闻无疑是百济神州的Brukinsa(泽布替尼)获得FDA批准,成为首个获得FDA批准的国内创新药,该药也是首获美突破性疗法认定的国内创新药。作为全球第三个获批的BTK抑制剂,泽布替尼对标的是2018年全球销售额超过62亿美元的伊布替尼,由于有更强的选择性,泽布替尼被认为有望实现更高的安全性。2019年泽布替尼启动了一项针对伊布替尼的头对头临床,稍显遗憾的是,尽管在安全性和耐受性泽布替尼显示出优势,但核心疗效两个药物并无统计学差异。
九期一(甘露特钠)成为十余年来唯一获批的治疗轻中度阿尔茨海默症用药,这一突破即便放到全世界也是让人瞩目的。甘露特纳的药理研究结果显示其通过改变患者菌群从而调节脑肠轴;临床研究结果揭示,相比于安慰剂,九期一可明显改善轻度AD患者认知。鉴于产品的临床试验方案设计,以及一些负面消息,部分业内人士对该产品存在一些质疑,我们期待不久以后有更大样本量、更长疗程,并且针对现有标准药物的头对头研究结果,以打消质疑者对这一国内创新药的顾虑。
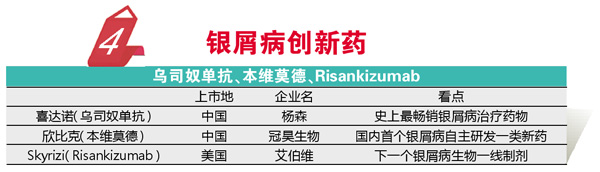
2019年是国内银屑病治疗极具意义的一年,共有5个创新药品上市或获批,其中包括颇具市场“钱力”的喜达诺(乌司奴单抗)。杨森的喜达诺是史上最畅销的银屑病治疗药物,GlobalData发布的2025年全球最畅销药物TOP10榜单也将该产品排到了第九的位置。2019年该产品正式在中国上市,作为靶向IL-12和IL-23的单抗,该药只需每三个月给药1次即可有效控制重度银屑病患者病情。
除了喜达诺,诺华的司库奇尤单抗和礼来的依奇珠单抗两个IL-17a抑制剂也在2019年相继获得了NMPA的批准。年前最后一周NMPA还批准了全球首个上市的IL-23单抗特诺雅(古塞奇尤单抗)。再加上TNF-α抑制剂,国内银屑病生物治疗已经有了众多的选择。
在轻中度银屑病治疗方面,外用制剂依然是常规的选择,2019年冠昊生物研发的创新小分子银屑病软膏剂欣比克(本维莫德)获批上市。该药是国内首个银屑病领域自主研发一类创新药,属于芳香烃受体调节剂,Ⅲ期临床该药选择了经典的卡泊三醇软膏作为对照药,结果显示治疗缓解率优于对照药。2019年NMPA还批准了数个创新中药,其中包括银屑病用药蛇床子总香豆素软膏,该药可缓解轻中度银屑病的病情。
2019年FDA也批准了数个银屑病药物,其中包括艾伯维的Skyrizi(Risankizumab)。Skyrizi是全球第三个获批的IL-23单抗类抗银屑病药物,虽然不属于first-in-class类创新药物,但其一系列研究结果让业界瞩目。与乌司奴单抗头对头对照的研究结果显示,其完全皮肤清除(PASI 100)结果显著优于对照物,与阿达木单抗的头对头研究也得到了显著优于对照药的结果。鉴于这两项针对目前银屑病生物制剂一线药物临床对照研究的强大循证医学结果,业内普遍看好Skyrizi有望成为下一个银屑病生物一线制剂,研究机构EvaluatePharma认为该药是2019年FDA批准药物中最畅销的产品,年销售额有望达到37亿美元。
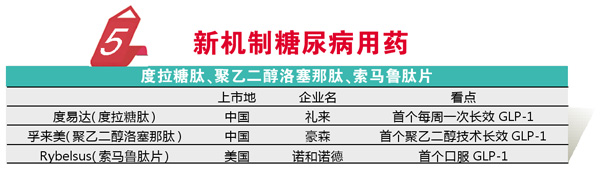
与FDA不同,我国对一些常见病多发病用药的研发还有巨大的需求,因此NMPA批准的药品依然主要针对这类疾病,其中最典型的是糖尿病用药,中国正在高速增长的糖尿病患者人群是推动糖尿病用药研发的首要原因。2019年NMPA批准了4个糖尿病创新药物,对于广大“糖友”而言,无疑是一个福音。
在糖尿病治疗领域,GLP-1抑制剂一直是一个研究热点,在艾塞那肽和利拉鲁肽获批后,长效GLP-1无疑成为了关注的热点,给药频次的降低将大幅提升患者治疗的依从性。2014年获得FDA批准的度易达(度拉糖肽)是首个仅需每周给药一次的GLP-1抑制剂,由于平稳降糖和给药频次大幅降低使得该药迅速成为最畅销的糖尿病用药之一,2019年礼来的度易达获批进入中国。
豪森的孚来美(聚乙二醇洛塞那肽)也获得了NMPA的批准。作为自主原创药,该药是全球首个通过聚乙二醇技术研发的长效GLP-1类药物,同样仅需每周给药1次。
正当我国在GLP-1用药实现长效化突破的同时,美国已经迈向了口服GLP-1时代。2019年9月诺和诺德的Rybelsus(索马鲁肽片)获批上市,成功解决了多肽类药物无法口服的问题,通过将索马鲁肽包裹于SNAC,从而避免索马鲁肽被胃酸破坏。与一周一次的度拉糖肽相比,Rybelsus糖化血红蛋白控制更佳,同时体重控制更好、安全性更优。数据的完胜和口服的加成,让我们对其期待更高。
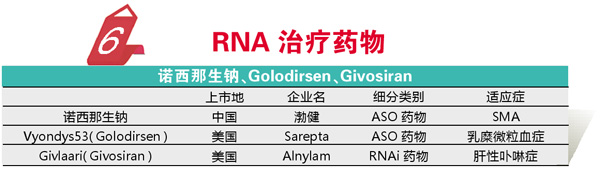
在一些难治性疾病治疗出现瓶颈时,往往换一个思路就会带来更多机会。考虑到RNA在人体蛋白合成中的信使作用以及一系列生理调控作用,RNA治疗药物一直是药物研发的一个方向。2019年,多个基于RNA的药物获批,表明RNA药物对一些疑难疾病的治疗已成为可能。
RNA治疗药物中走得最快的应该是反义寡糖核酸(ASO),包括前面提到的诺西那生钠,该药是首个获得临床及市场认可的RNA药物。2019年开发诺西那生钠的伊奥尼斯制药又在EMA成功获批了用于乳糜微粒血症的Waylivra(Volanesorsen),不过该药因安全性问题尚未得到FDA的批准。2019年FDA也批准了一款ASO药物,为Sarepta公司的Vyondys53(Golodirsen),该产品对于约占8%的杜氏肌营养不良症患者有确切疗效,仅需持续用药,患者的肌肉功能即可基本恢复正常水平。
RNAi药物在RNA药物研发中始终占据重要的位置,通过小干扰核酸可以影响信号传递。2018年,Patisiran成为首个获批的该类药物。2019年Alnylam治疗肝性卟啉症的RNAi药物Givlaari(Givosiran)也获得了FDA的批准,这是首个获批的治疗肝性卟啉症用药,仅需每月注射一次,患者疾病发作频次即可降低超过70%。
除了罕见病领域,RNAi在一些国内高度关注的常见病中也有机会,其中有两个处于后期临床备受关注的品种:聚焦PCSK9靶点的Inclisiran是目前降低低密度脂蛋白最强的药物;而ARO-HBV可以彻底清除HBV患者ccc-DNA,有望从根本上治愈乙肝。
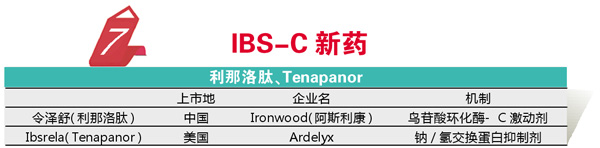
IBS(肠易激综合征)是一种困扰大量人群的消化系统疾病。根据症状的不同,IBS分为腹泻型、便秘型和混合型,其中便秘型IBS也就是IBS-C目前缺乏有效的治疗手段,一直期待有效的药物。2015年Ironwood公司的鸟苷酸环化酶-C激动剂利那洛肽获得FDA的批准,该药可刺激氯离子和碳酸氢根离子分泌进入肠道,从而加快物质从小肠通过,同时还可以降低内脏疼痛感。2019年阿斯利康将该产品引入中国,商品名为令泽舒,这一药物的引进无疑为国内IBS-C患者提供了一个可靠的治疗选择。
2019年FDA也批准了一个IBS-C类药物,为Ardelyx的Ibsrela(Tenapanor)。Ibsrela是创新机制的钠/氢交换蛋白抑制剂,能够刺激肠道蠕动,并增加患者肠道的液体分泌,同时由于Ibsrela不被人体吸收,不良反应可控。该药针对透析患者高磷血症的Ⅲ期临床也正在进行。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






