试点扩大21地区,广东经验有何看点?
发布时间:2020-01-10 17:08:17作者:特约撰稿 李丹荣来源:医药经济报
系列导语
深化“放管服”
医疗器械产业是多学科交叉、知识密集型和资金密集型的高技术产业,同时监管准入严格,是高度政策性导向的产业。从国内外医疗器械产业发展经验来看,医疗器械监管法规政策对推动产业的发展至关重要,是促进产业发展的催化剂。
当前,我国医疗器械产业处于快速发展期,在中低端医疗器械产品方面基本实现了进口替代,但在技术密集的高端医疗器械,如高端CT、核磁、内窥镜等领域,国产近年才陆续实现零突破,市场仍然主要由国外进口医疗设备主导,亟需掌握更多高端医疗器械核心技术和自主知识产权。
此前召开的中央经济工作会议,提出深化“放管服”改革,大力降低实体经济成本;通过“简政放权、放管结合、优化服务”(即“放管服”)营造公平便利的市场环境,降低制度性交易成本,充分调动市场主体积极性,推动创新,促进经济持续友好发展。医疗器械产业正处在向创新型转变的关键时期,亟需“放管服”改革政策为产业高质量发展提速“加油”。(敬请关注2019医械年度盘点之“放管服”政策助推医疗器械产业高质量发展系列报道。)
“放”——医疗器械注册人制度试点释放市场活力
12月3日,山东省药品监督管理局召开新闻发布会,解读《山东省医疗器械注册人制度试点工作实施方案》,实施方案要求,住所或者生产地址位于山东省内的企业、科研机构可以提出申请,取得医疗器械注册证后,成为医疗器械注册人,可以自行生产或者委托企业生产第二类、第三类医疗器械。
医疗器械注册人制度,是当前医疗器械领域推行的重大改革制度,这种制度解除了此前医疗器械产品注册许可和生产许可“捆绑”的审批管理模式,能够有效促进医疗器械行业资源的合理配置,加速医疗器械产品的创新研发产业化。
A试点情况
试点区企业占全国主要器械生产企业半数以上
自2017年12月起,医疗器械注册人制度先后在上海、广东、天津、北京试点实施,试点范围涵盖我国医疗器械产业集聚的长江三角区域、珠江三角区域、京津环渤海湾,试点区域的医疗器械生产企业占全国主要医疗器械生产企业半数以上。2019年8月1日,国家药品监督管理局发布《关于扩大医疗器械注册人制度试点工作的通知》(国药监械注〔2019〕33号),在前期上海、广东、天津自贸区开展医疗器械注册人制度试点工作的基础上,将医疗器械注册人制度试点扩大到上海、广东、天津、北京、湖南等21个省(区、市)。
B广东经验
5家企业48个产品获准许可
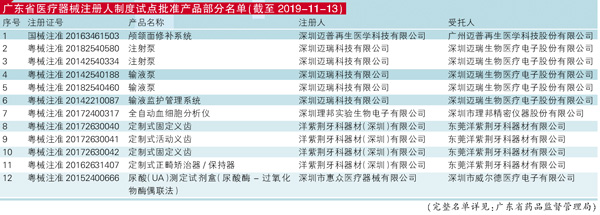
医疗器械注册人制度试点一年多以来,社会反响强烈,也获得了业内高度关注,取得了一定的成效。以广东省为例,截至2019年11月13日,广东共有迈瑞、理邦、洋紫荆、深圳迈普、深圳惠众5家企业48个产品按照试点方案获准许可(见表:广东省医疗器械注册人制度试点批准产品部分名单)。尤其深圳迈普再生医学科技有限公司试行医疗器械注册人制度委托广州迈普再生医学科技股份有限公司生产颅颌面修补系统(注册证编号:国械注准20163461503),是医疗器械注册人制度试点实施后全国首张获批的第三类医疗器械注册人制度试点注册证,具有较强的示范意义。
2019年10月10日,广东省发布“医疗器械注册人制度试点下第二类医疗器械注册证变更办理程序”,对于满足纳入广东省医疗器械注册人制度试点、与产品质量相关要素没有发生改变、质量管理体系和产品技术文档有效转移、上市产品质量责任主体明确等条件的集团公司内部注册人变更,予以办理登记事项变更。广东省药品监督管理局在全国率先对集团公司内部医疗器械注册人变更先行先试,可以实现优化集团公司内部资源配置,激发企业创新创造活力,助推广东省医疗器械产业高质量发展,为医疗器械注册人制度全国推广贡献广东经验。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






