站在巨人肩上推进改良型新药研发
发布时间:2020-01-10 13:55:21作者:特约撰稿 刘璇来源:医药经济报
开头语<<<
《药品注册管理办法》的修订无疑是继新修订药法颁布后医药产业界的又一重要议题。于前段时间结束征求意见的注册管理办法征求意见稿,相较于9月30日发布版本又有所不同。其中最大的不同在于给予改良型新药更多的关注——新版征求意见稿中,不仅将改良型新药纳入上市药品目录集收录范围,还在药品注册申报方面,尤其是加快上市注册、优先审评审批等方面,对改良型新药予以政策鼓励。
505(b)(2)为什么这么热
近年来,国内医药产业发展持续升温,生物医药行业生态链在国家政策的支撑和资本的大力投入下不断走向成熟。“4+7”带量采购的推进以及《化学药品注射剂仿制药质量和疗效一致性评价技术要求(征求意见稿)》、《药品注册管理办法(修订草案征求意见稿)》等政策的相继出台,显示了国家政策层面对仿制药提出了更高更严的要求,也对创新药和改良型新药表达了充分的鼓励姿态。
唯有不断创新,提高药品质量,研发具有高附加值的新药产品,才是行业高质量发展的出路。
505(b)(2)式开发
与完全创新药相比,改良型新药具有较多优势。
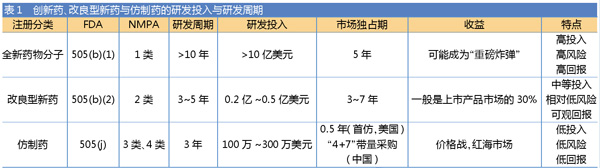
改良型新药在国内按注册分类2类新药申报,在美国按照505(b)(2)途径申报,被誉为“站在巨人肩上”的新药开发模式,它可以参考已上市新药数据、已发表文献,作为药物安全性和有效性的依据进行新药申报。
505(b)(2)的申报先后经历了可行性分析、药物制剂开发、Pre-IND会议、非临床研究、临床研究和NDA提交等过程。受益于大量已有药物的安全性、有效性数据,申报过程中可以申请减免非临床研究和临床研究。
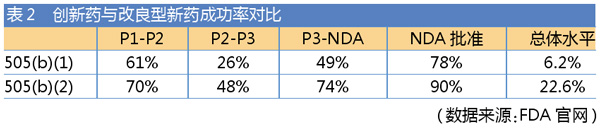
与505(b)(1)创新药相比,505(b)(2)申报研发周期短、研发投入较少、拥有3~7年市场独占期、回报较高(见表1),且成功率相对较高(见表2)。不论从研发难度还是“投入-收益比”来考量,505(b)(2)均具有一定优势。
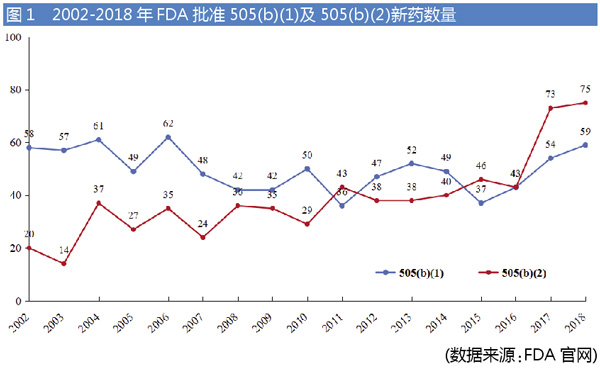
近20年美国FDA批准新药数据表明,505(b)(2)新药数量逐年增加。2015年后,505(b)(2)批准数量更是超过了505(b)(1),如图1所示。
重点“靶向”哪些领域
查阅资料发现,505(b)(2)目前关注的热点包括“老药新用”、同一适应证的改良以及新复方制剂的研发。其中,增加适应证、增加儿童用药品种的“老药新用”,是对药品应用范围的拓展,在抗肿瘤新药开发领域尤为多见。
针对同一适应证的,需根据临床用药的实际需求,对原研品种进行成盐、成酯、成络合物或拆分光学异构体,或改变给药途径,或改变剂型或配方,或调整给药剂量和频率,或改Rx为OTC,以实现对药品的改良。新复方制剂的设计,则需根据药品的配伍使用,设计新产品。对比国内的2类新药,FDA的505(b)(2)还囊括了新活性成分制剂申报。
值得注意的是,NMPA和FDA对改良型新药要求“具有明显临床优势”:一方面,对新申报品种提出这一要求,将增加改良型新药与已上市品种的区分度,减少同质化竞争;另一方面,鼓励药品研发机构在药品临床表现上下功夫,将研发资源和产能投入到改进药品质量、提升药物疗效、满足患者需求上。临床需求是新药研发的重要出发点,临床优势,将成为产品的核心竞争力。
同时,还对改良型新药的开发提出了一定技术要求。只有通过对已有品种的适应证及作用靶点、临床未解决问题、API理化性质、制剂ADME过程进行深入细致的调研,对制剂技术细节进行踏实缜密的研究,并对药品生产不断改进并深入优化,才能开发出安全性好、质量更优的改良型新药品种,进而占据相应的市场份额并保有竞争力。例如,药欣生物已获得的FDA 505(b)(2)临床批件的产品,便是基于临床应用中发现的问题,针对不同病人吸收差异大、饮食对药物吸收影响显著,根据难溶性原料药的理化性质,做出制剂技术改进,消除饮食影响,提高药品质量。
成就划时代新药
经典案例
事实上,很多具有划时代意义的新药,正是通过505(b)(2)途径完成申报的。例如,阿霉素脂质体注射液(DoxilR)、白蛋白结合型紫杉醇(AbraxaneR)通过新剂型解决了药物溶解性问题,改变了药物体内分布,实现了药物疗效增加及毒副作用降低。洛伐他汀缓释片(AltocorR)、吗啡缓释制剂(AvinzaR)通过新剂型设计,实现给药频率下降,显著提高了患者顺应性。
其中,紫杉醇制剂的研发,堪称改良型新药研发的经典案例。紫杉醇是作用于微管蛋白抑制肿瘤细胞增值的天然来源抗肿瘤药,对几乎所有实体瘤有效。作为全球第一个上市的紫杉醇制剂,TaxolR自1992年上市后,成为晚期卵巢癌、非小细胞肺癌、HER-2阳性转移性乳腺癌的一线用药,为原研企业BMS累计带来超过145亿美元的收益。但是,这个产品也存在重大缺陷,其制剂中含有的聚氧乙烯蓖麻油成分易引起过敏反应,这使TaxolR不得不背上“过敏及严重过敏反应2%~4%发生率”的黑框警告。不过,这也为紫杉醇的改良留下不少空间。
2003年后,Luye Pharma、Celgene、Samyang、Oasmia等公司陆续开发上市了紫杉醇脂质体LipusuR等一系列新剂型品种,在祛除过敏反应相关辅料的同时,大幅度降低了不良反应,增加载药量,成功拓展了药品的有效性与适应证。这些改良型新药用高门槛、独创性的制剂技术,切实解决了临床问题,使药物的治疗作用得到了充分发挥,也为研发企业及个人带来了丰厚的回报。
申报优势明显
改良型新药的研发申报是对已上市药品不断改进的重要方式,是通过制剂技术提高药品附加值的重要途径,也是企业渗透并占据市场份额的有力手段。
站在药品研发角度,505(b)(2)改良型新药可实现对新分子实体药物的持续改进,是不断优化产品的重要方式。自1973年诺华第一个双氯芬酸药物上市至今,40余年间已有十几家大型药企开发了近20种不同制剂产品,目前仍有14家厂商的15种产品在研。
站在产品布局角度,505(b)(2)改良型新药申报是推动技术产品衍生、搭建技术平台的重要途径。2015年,FDA先后批准了Tris、Vernalis和Pfizer制药公司利用Tris制药的缓释技术开发的3个重磅改良药物。据此,Tris制药的缓释技术平台在新药开发中发挥了重要作用。
站在产品研发企业角度,505(b)(2)改良型新药是延长产品生命周期,占据新产品市场的重要方法。武田制药在没有化合物专利的情况下,通过制备微球制剂对亮丙瑞林注射剂进行改良,实现了长时间占据市场领先地位的目标。
带给本土企业的实践思考
对于研发企业来说,专利是改良型新药开发中的关注重点。如何利用改良型新药申报,形成由专利优势构成的技术壁垒,显得尤为重要。
对原研厂家来说,围绕新药品种开发改良型新药,是对原有专利的补充,更是延长专利保护期的重要方式。对其他企业来说,通过研发申报改良型新药,是占据市场份额的重要途径,是将技术优势转化为市场优势的重要手段。前文提到的武田制药以及紫杉醇制剂研发厂家Luye Pharma和Celgene,正是通过研发具有自主知识产权的高技术型改良品种,获得了较大市场份额。
同时,深度把握行业趋势,制定行之有效的商务策略,合理布局产品管线,也是企业在改良型新药开发中应着重关注的。立项前,应从商业角度,对拟开发产品进行可行性、未来竞争力、替代潜力、回报方式等方面进行考量;申报成功后,则应根据产品的目标人群、目标市场制定合适的销售计划和推广方案,使该改良型新药占据尽可能多的市场份额,为研发企业获得尽可能多的商业回报。
(本文作者供职于药欣生物科技有限公司物理药学部,陈顺对本文亦有贡献)
小结<<<
说到底,技术竞争力是改良型新药产品商业竞争力的源头。而产品的技术竞争力,不仅决定于技术平台的先进性,也决定于立项的角度与出发点。企业必须充分调研评估,结合自身实际,勇于面对具有挑战性的技术难题,开发临床急需的品种(例如儿童药、罕见药),进而占领创新高地。
改良型新药研发申报,是一个涉及法规、技术、临床、商务等的综合性议题。只有找准临床切入点,明确相关政策与申报途径,较早实现有效专利布局,并结合精准的市场分析与商务推广,才能实现改良型新药的成功开发,有所作为。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






