鼓励仿制产品 带量采购竞争力预判
发布时间:2019-12-16 17:14:12作者:本报特约撰稿 边界来源:医药经济报
鼓励仿制产品 带量采购竞争力预判
从“4+7”仿制药带量采购到联盟仿制药带量采购,从仿制药独家中标到允许3家企业中标,最终展示的都是一个结果——生产厂家数越少,降价幅度越低。
因此,企业在立项布局《第一批鼓励仿制药品目录》时需要考虑:如果这个产品需要面临带量采购的价格竞争,那么立项是否还具备价值?
剔除分析:或与专利有关,立项不容忽视
2019年6月,国家卫生健康委联合科技部、工业和信息化部、国家药监局、知识产权局等部门组织专家,对国内专利到期和专利即将到期尚没有提出注册申请、临床供应短缺(竞争不充分)以及企业主动申报的药品进行遴选论证,提出了《第一批鼓励仿制药品目录建议清单》。
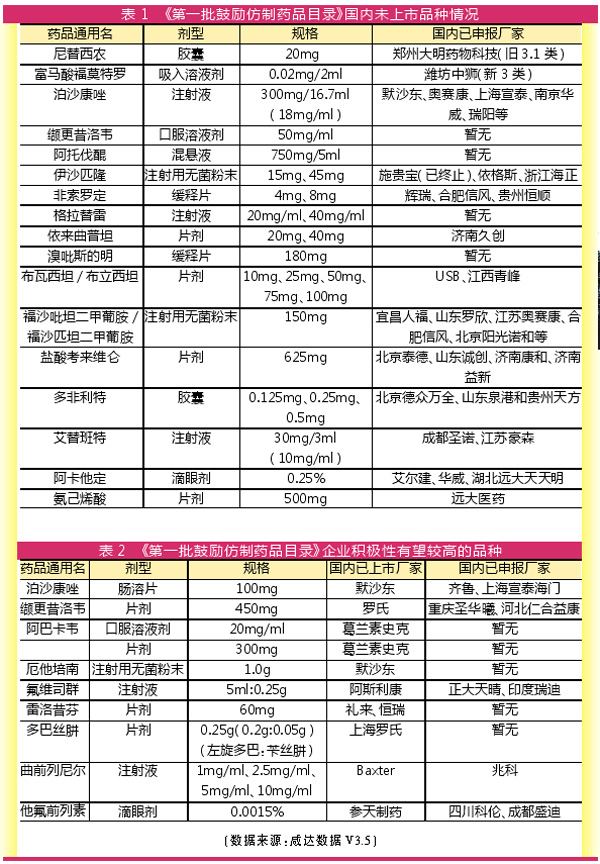
三个多月后,《第一批鼓励仿制药品目录》于2019年10月正式发布。除了利匹韦林片剂25mg外,《第一批鼓励仿制药品目录建议清单》的其余产品都进入目录。强生的抗艾滋病新药利匹韦林2018年10月才在中国内地上市,为新一代非核苷类反转录酶抑制剂,最终没有出现在首批正式目录中。预计与其专利尚未到期有关。
纳入特征1:国内未上市
需启动验证性临床,成本较高
从产品的申报情况来看,纳入《第一批鼓励仿制药品目录》主要有三种情况:
一是国内暂无原研厂家或仿制药厂家申报的产品。《第一批鼓励仿制药品目录》主要是为推动这类产品在研的国内厂家的上市进程。咸达数据V3.5数据显示,这类产品包括缬更昔洛韦口服溶液剂50mg/ml,阿托伐醌混悬液750mg/5ml,格拉替雷注射液20mg/ml、40mg/ml,溴吡斯的明缓释片180mg。
其中,某些产品虽然没有生产厂家申报注册,但非常有可能已经有生产厂家在研。例如格拉替雷,虽然国内暂无产品上市及注册申报,但翰宇药业在2015年已经公告与Akorn合作出口格拉替雷制剂。
鉴于此类药品属于新3类上市,通常国内厂家申报都需要启动验证性临床,上市成本较高。
纳入特征2:多家上市、无过评者
过评动力不足,或遇技术等瓶颈
二是国内仿制药已经多家上市,但暂无生产厂家通过一致性评价。《第一批鼓励仿制药品目录》纳入这类产品,也有可能是为了推进这类产品的已上市厂家通过一致性评价。这类产品包括氨苯砜、巯嘌呤、甲氨蝶呤、环磷酰胺、硫唑嘌呤、左甲状腺素钠、溴吡斯的明等品种的片剂。
鉴于这类产品已经上市销售,有一定的销售基础,企业之所以迟迟未启动一致性评价,往往有目前销售不乐观、或参比制剂已经退市、或制剂技术有门槛、或一致性项目整体成本与销售收益相比不乐观等因素。
对于这类产品,纯粹政策上出台鼓励仿制药品目录,能否促进企业积极申报,仍待时间证明。
纳入特征3:原研药已上市
只需完成BE,企业首仿动力大
三是国内专利过期原研药已上市,但暂未有首仿药申报的产品。例如葛兰素史克的阿巴卡韦口服溶液剂20mg/ml及片剂300mg、默沙东的厄他培南注射用无菌粉末,以及罗氏的多巴丝肼片剂等。对于这类产品,《第一批鼓励仿制药品目录》有助于推动首仿药的上市。这些产品往往只需要完成生物等效性临床研究就可以上市。
此外,国内专利过期原研药已上市、但申报厂家少于3家的产品,也将是比较受重视的立项标的。
展望<<<
自2016年仿制药开始改革以来,无论是儿童仿制药鼓励目录还是《第一批鼓励仿制药品目录》,通常都是由卫健委作为临床需求方发布目录。然而,最终企业积极响应并且能快速上市的项目并不多。
原因是多样的,归根到底是——对于企业来说,产品立项是一项投资行为,除了政策的激励还要考虑产品研发的可行性、市场回报的风险等多维度因素,产品从立项到营销都是企业承担风险。如果没有例如优先进入医保等能够保障企业投资回报的政策激励,预计企业的热情度依然不会太高。目前,仅市场潜力大的产品(如氟维司群)有较多企业愿意投入并加入竞争行列。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






