“附条件批准上市”攻略
发布时间:2019-12-04 16:54:43作者:本报特约撰稿 镜陆来源:医药经济报
吸睛的GV-971,临床研究有何诀窍?
不久前刚刚获得有条件上市批准的甘露特钠胶囊(GV-971,商品名“九期一”),尤其引发业界关注。
GV-971是以海洋褐藻提取物为原料制备的低分子酸性寡糖化合物,用于轻度至中度阿尔茨海默病(AD),改善患者认知功能,是我国自主研发的创新药,获得国家重大新药创制科技重大专项支持。
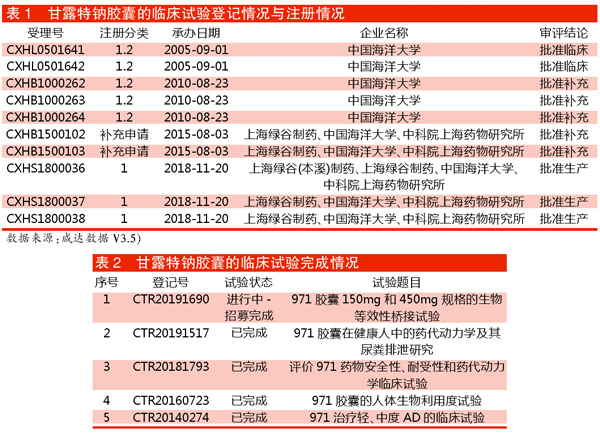
从上市历程看,该药2005年由中国海洋大学发起申报临床,耗时13年才于2018年申报生产,最终1年内获批上市,为“有条件批准上市”。
之所以“有条件批准上市”,是因为AD发病机制十分复杂,病程时间长,治愈难度大,国家药监局要求申请人上市后继续进行药理机制方面的研究和长期安全性有效性研究,完善寡糖的分析方法,按时提交有关试验数据。但无论如何,该药的上市为患者提供了新的用药选择。
临床试验完成情况
从目前CDE公开的药物临床试验登记与信息公示平台可见,971胶囊登记在案的试验有5个。该平台于2013年正式启动使用,但近两年才硬性规定临床试验登记。971胶囊登临床试验完成情况见表2。
CTR20140274(Ⅲ期临床,已完成)
2014年启动的临床试验已是Ⅲ期临床,使用符合美国国立神经病学、语言障碍和卒中研究所阿尔茨海默病及相关疾病协会(NINCDS-ADRDA)AD诊断标准(1984)的简易智力状态检查量表(MMSE)。目标国内试验1006人,实际国内试验818人,为双盲试验。连续用药共计36周。主要终点为认知功能改善,使用AD评价量表的认知部分(ADAS-cog/12项)评分。
次要终点包括:1)整体评价,用印象评估量表(CIBIC-plus)评分;2)日常生活功能的改善,用日常生活功能量表(ADCS-ADL)评分;3)神经精神行为的改善,用神经精神症状问卷(NPI)评分;4)神经影像学变化,测FDG-PET感兴趣区脑葡萄糖代谢率。除了第4项研究周期为24周,其余都是36周。
该试验的主要研究单位为上海交通大学医学院附属精神卫生中心中国医学科学院北京协和医院。此外,北京、上海、天津、广东、江苏、浙江、山东等多地的32家医院也参与了这个试验。
CTR20160723(Ⅰ期临床,已完成)
2016年启动的临床试验是971胶囊(150mg/300mg/450mg)在中国男性健康志愿者中的单剂量、双盲、随机、三周期、三交叉设计、安慰剂对照生物利用度试验,入组15人,在上海市徐汇区中心医院完成。
主要终点指标为药代动力学参数:Cmax、AUC0-last、AUC0-∞。次要指标为:1)药代动力学参数:Tmax、λz、t1/2;2)安全性评价:包括AE、临床实验室检查(血常规、血生化和尿常规)、生命体征、体格检查和ECG。
CTR20181793(Ⅰ期临床,已完成)
2018年11月报产前,上海市徐汇区中心医院于2018年8月又启动了单次及多次给药、双盲、随机、安慰剂对照评价971胶囊在中国健康志愿者中的安全性、耐受性和药代动力学Ⅰ期研究,目标和实际入组都是45人。主要终点为安全性指标包括生命体征、体格检查,12导联心电图、临床实验室检查指标,不良事件与严重不良事件等。
次要终点包括:单次给药药代动力学参数:Tmax、Cmax、AUC0-t、AUC0-inf、λz、t1/2、%AUCex、CL/F、V/F等;2)多次给药药代动力学参数:AUC0-Tau、Tmax、Cmax、Cmin、Cavg、AUC0-t、AUC0-inf、λz、t1/2、%AUCex等;3)人体尿液中971各组分的相对含量。该试验第一例受试者入组日期为2018年10月9日,试验终止日期为2018年12月29日。
CTR20191517(Ⅰ期临床,已完成)
2019年登记号为CTR20191517的研究是971胶囊在中国健康志愿者中的药代动力学及其尿粪排泄的探索性研究,入组8人,依然在上海市徐汇区中心医院研究。主要终点包括2个:一是药代动力学指标:Tmax、Cmax、AUC0-t、AUC0-inf、λz、t1/2、%AUCex、CL/F和Vd/F等。二是尿样及粪样中药物的累积排泄量及排泄百分率。
次要终点指标及评价时间为安全性指标。根据国家癌症研究所常见不良事件标准术语5.0版,对不良事件进行评估,对不良事件分级。指标包括生命体征、体格检查、12导联心电图、临床实验室检查指标(血常规、尿常规、血生化)、不良事件与严重不良事件等。
CTR20191690(Ⅰ期临床,进行中)
2019年8月登记号为CTR20191690启动。研究的主要目的是在空腹状态下对450mg规格的971胶囊(受试制剂)与150mg规格的971胶囊(参比制剂)在中国健康受试者体内进行生物等效性桥接评价。次要目的为观察受试制剂和参比制剂在中国健康受试者中的安全性。入组24人,还是在上海市徐汇区中心医院。主要终点为药代动力学参数:Tmax、Cmax、AUC0-t、AUC0-inf、λz、t1/2等。
次要终点为根据美国国家癌症研究所常见不良事件标准术语5.0版,对不良事件进行评估,对不良事件分级。
据悉,NCT01453569没有在国内登记,其适应症是轻到中度AD。入选AD患者共255例,分为三组:GV-971 600mg和900mg以及安慰剂组,用药24周。研究结果显示,900mg组对ADAS-cog12的改善较600mg组更明显(-2.58 VS-1.39),600mg组与安慰剂相比没有显著差异。NPI问卷两组较安慰剂均没有明显改善。
“附条件批准上市”详解
目前,轻中度AD指南一线用药为多奈哌齐。在没有和多奈哌齐做PK优效前,GV-971得到上市批准,或许与药监部门近期推动的临床急需药品附条件批准上市政策相关。
2019年11月8日,CDE发布关于《突破性治疗药物工作程序》和《优先审评审批工作程序》征求意见的通知,以及关于再次公开征求《临床急需药品附条件批准上市技术指导原则》意见的通知。
GV-971预计属于临床急需药品附条件批准上市的产品。所谓附条件批准上市,是指用于治疗严重危及生命且尚无有效治疗手段的疾病以及罕见病的药品、公共卫生方面急需的药品,现有临床研究资料尚未满足常规上市注册的全部要求,但药物临床试验已有数据显示疗效并能预测其临床价值,因临床急需,在规定申请人必须履行特定条件的情况下基于替代终点、中间临床终点或早期临床试验数据而批准上市。
涉及哪些临床需求?
附条件批准上市所认定的未被满足的临床需求通常包括以下情况:
1. 无批准可用的治疗方法;
2. 有可用的治疗方法:当一种疾病存在可用的治疗方法,如果新的治疗药物能满足下述条件之一,通常也被认为可解决未满足的临床需求:
1)与现有疗法相比,对疾病的预后有明显改善作用;
2)用于对现有疗法不耐受或无疗效的患者可取得明显疗效;
3)可以与现有疗法不能联用的其他关键药物或治疗方式有效地联用并取得明显疗效;
4)疗效与现有疗法相当,但可避免现有疗法的严重毒性,或降低有害的药物相互作用,或显著改善病人的依从性;
3. 解决新出现或预期会发生的公共卫生需求。
鉴于AD目前的指南推荐用药,以及GV-971目前启动的临床试验,GV-971的获批更倾向于“解决新出现或预期会发生的公共卫生需求”,即解决我国人口老龄化问题。
替代终点和数据选择?
对于临床急需药物,可基于替代终点、中间临床终点或早期临床试验数据而附条件批准上市。
1.有效性评价终点指标
通常用于药物有效性评价的指标应为临床终点。临床终点是指可以直接测量药物疗效的特征或变量,即药物对患者感觉(例如症状缓解)、功能(例如运动性改善、延缓或阻止功能衰退等)或生存影响的直接评价。
用于附条件批准临床急需药品上市的有效性评价终点通常有两类:
1)很可能预测临床获益的替代终点。替代终点一般是一个生物标志物,可以是实验室检查项目、放射影像学、体征或其他指标,其本身并不衡量临床获益,但可以预测临床获益。依据其对临床获益的预测能力,替代终点可以是已知可以合理预测临床获益的指标,或者是很可能预测临床获益的指标。
2)可以早期评估临床获益的中间临床终点。中间临床终点一般是指在治疗慢性疾病的临床获益评价中,通常认为短期临床获益很可能预测长期临床获益。例如,治疗多发性硬化病的药物在获得常规批准时需要提供2年的用药临床疗效评价,而在附条件批准时,中间临床终点指标则是1年的用药疗效评价。
在确证性临床试验中,应用替代终点指标或中间临床终点指标的研究结果可以合理预测该产品很可能具有疗效和临床获益的,可给予附条件批准上市。
2.早期临床试验数据
早期临床试验数据通常是指在开展确证性临床试验前所获得的临床数据。根据早期临床试验数据,可合理预测或判断其临床获益的,可以在完成确证性临床试验前给予附条件批准上市。
从目前公布的临床试验来看,GV-971更偏向于凭早期临床试验数据上市。
可能撤销批准的情况?
值得注意的是:附条件批准上市的撤销只要包括有以下情形之一的,国家药品监督管理局依法处理,直至注销附条件批准药品的药品注册证书:
(一)逾期未按要求完成后续相关研究且无合理理由的;
(二)要求证实药品预测临床获益的试验未能证实该获益的;
(三)上市后临床研究结果经审评不能证明获益大于风险的;
(四)其他不符合继续上市条件的情形。
国家药监局只要求申请人上市后继续进行药理机制方面的研究和长期安全性有效性研究,完善寡糖的分析方法。这意味着GV-971无需与目前的疗法做对照。
虽然注册申报未要求GV-971进一步研究与现有疗法相比的获益程度,但基于医保支付的考量,GV-971或许需要一份与现有疗法相比更优的药物经济学数据。
小结<<<
无论是PD-1还是GV-971,还是临床急需进口新药加快上市,都体现了我国药政部门从临床需求出发、加快国内外新药上市、争取国内治疗手段能够与世界同步的出发点。
然而,这并不意味着药监部门的标准放松。附条件批准是有严格要求的,意在兼顾“临床急需需求”与“保障上市药品安全有效”。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






