改革加速度带来黄金期
发布时间:2019-11-14 12:03:13作者:本报记者 李蕴明来源:医药经济报
改革加速度带来黄金期
自9月30日《药品注册管理办法(征求意见稿)》通过国家药品监督管理局网站向社会公开征求意见后,国家药监局根据各方意见建议组织对内容进一步修改完善,再次通过中国政府法制信息网向社会公开征求意见,反馈时间也调整至2019年11月14日前。
此次最典型的变化之一就是为“药品加快上市注册”单独设立一章,以鼓励创新及满足临床需要。对于正在积极向创新药方向转型的药企来说,无疑是有了更加明晰的指引——以临床价值为导向的药物创新。
进一步释放创新活力
自从《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》发布以来,中国医药产业的“创新”在快速发生变化:曾经风行一时的“微创新”开始消退,具有临床价值、拥有更长产品生命周期的创新成为“王者”。
与全球新药研发管线的对比中,也可以看到中国医药创新的进步。麦肯锡报告显示,2016年中国在全球新药研发管线方面的贡献为4.1%,在全球新药上市方面的贡献则为2.5%;而到了2018年,这两个数字已经分别跃升至7.8%和4.6%。
《2018年度药品审评报告》也披露,去年全年CDE受理1类创新药注册申请共264个品种,较2017年增长21%。其中,受理1类创新药的新药临床试验(IND)申请239个品种,较2017年增长15%;受理1类创新药的新药上市申请(NDA)25个品种,较2017年增长150%。
尤其在原国家食品药品监督管理总局发布并实施的《关于鼓励药品创新实行优先审评审批的意见》,以危重疾病和临床需求为导向,对具有明显临床价值等3大类、18种情形的创新药和临床急需、市场短缺药品优先审评审批。截至2019年10月27日,有950件注册申请经CDE公示拟纳入优先审评,研发创新活力进一步释放。
“而今中国已经成为世界第二大药品市场,医药创新跻身世界第二梯队。”中国化学制药工业协会执行会长潘广成指出,随着药品注册管理制度改革加速,创新药加速审批,重大新药创制等相关政策落地,全面吹响了我国医药创新的号角,带来了医药创新的发展黄金时期。
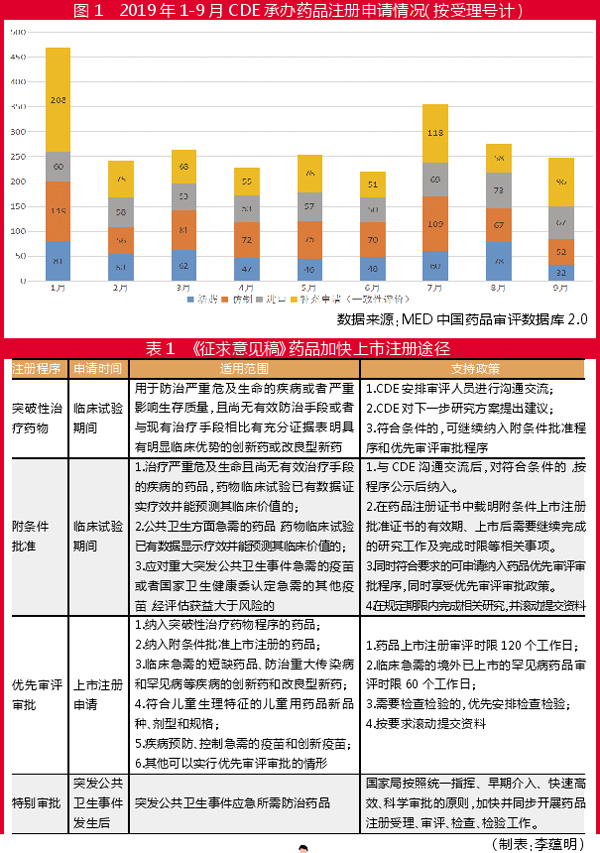
据MED中国药品审评数据库2.0统计,2019年1-9月CDE共承办新药507个(见图1)。
更明晰的快速通道
从今年9月审议通过的新修订《药品管理法》中,也可发现不少鼓励创新的条款。包括对临床急需的短缺药品、防治重大传染病和罕见病等疾病的新药、儿童用药品优先审评审批;对治疗严重危及生命且尚无有效治疗手段的疾病以及公共卫生方面急需的药品,药物临床试验已有数据显示疗效并能预测其临床价值的,可附带条件批准,并在药品注册证书中载明相关事项等。
从《药品注册管理办法(征求意见稿)》具体内容看,更多是结合国内实际,参考国际经验,分别设立突破性治疗药物、附条件批准、优先审评审批、特别审批四条快速通道,每条通道的适用范围、申请程序、支持政策和终止程序,以及不同通道的关系和衔接见表1。
分析人士指出,从四条快速通道的适用范围来看,随着解决积压逐渐进入尾声,优先审评已从解决药品审评积压、绕开积压排队等的通道,向激发创新、强调药品临床价值的方向调整。创新药、治疗重大疾病领域的药品必须具有临床价值、临床优势或能满足目前未被满足的临床需求才被考虑纳入优先审评。
回归临床需求的“绿色通道”
具体到药品品种,《药品注册管理办法(征求意见稿)》起草说明中点名的《药品管理法》《疫苗管理法》及国务院文件中列明的临床急需的短缺药、儿童用药、罕见病用药、重大传染病用药、疾病防控急需疫苗和创新疫苗等均纳入加快上市注册范围。
结合目前我国疾病谱由急性传染病转变为慢性非传染性疾病,心脑血管疾病、恶性肿瘤、慢性呼吸系统疾病等成为主要死因的大背景,未来国内的创新药研发需求将主要集中在恶性肿瘤、心脑血管疾病、糖尿病等慢性病领域,当然,抗感染药也仍将保持一定比例。此外,针对不同病种,在相应的文件中亦不乏鼓励的内容。如不久前印发的《健康中国行动——癌症防治实施方案(2019-2022年)》中就提出要促进境外新药在境内同步上市,畅通临床急需抗癌药临时进口渠道等。
此外,对于境外已上市临床急需新药,CDE分别在2018年11月和2019年5月发布两批临床急需境外新药名单,对共计78个药品提出免于国内临床试验,只需提交全部研究资料和不存在人种差异的支持性材料,即可直接申请上市,由此为海外创新药上市开辟快速审批通道。随着鼓励进口药政策的陆续颁布,境外未上市新药有望经批准后在境内外同步开展临床试验,并在中国完成国际多中心药物临床试验后,可以直接提出药品上市注册申请;对于已上市药品,境外临床试验数据无人种差异可直接申报上市,这些政策进一步加快了进口专利药的上市速度。更有甚者,如用于治疗正在接受透析治疗的患者因慢性肾脏病(CKD)引起的贫血的罗沙司他胶囊,更是实现了在中国全球首发上市的突破。
回归到整体数据上,新药审评审批速度进一步提升。近年,在政策环境更迭、审评人员增多等诸多因素的推动下,审评速度也显著加快。以上市/进口的生物药获批审评时长为例,治疗用生物制品审评时长已经从2013年的超过1600天逐步压缩到不到300天,审评效率提升明显。
不难推测,随着按时限审评常态化机制的建立与完善,未来创新药的国内上市审批速度还将进一步加快。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






