印药企获美仿制药 批文保持领先
发布时间:2019-11-05 17:06:48作者:Ramesh Shankar来源:医药经济报
印药企获美仿制药 批文保持领先
2019年上半年,从美国FDA批准的简略新药申请(ANDA)结果来看,印度制药企业再次展示了出色的能力。尽管仍面临着诸多不利因素,但印度药企及其子公司在进军高标准监管的美国药品市场、开发仿制药、获得FDA的大量正式批准以及临时批准的仿制药方面,体现了领先优势。
包揽四成新批ANDA
Pharmabiz数据显示,截至2019年6月底,印度制药公司及其子公司今年上半年共获批了207个正式ANDA,占美国FDA在此期间批准的476个ANDA的43%。与此同时,FDA共批准了102个暂定ANDA,印度制药公司获得了其中的55个。
事实上,印度药企一直承受着巨大的经营压力,若考虑到FDA对一些印度制药公司采取的质量特别监管和发出警示函等影响因素,上述成绩并不理想。不过,印度药企在成功解决质量监管问题上表现出了游刃有余的韧性。
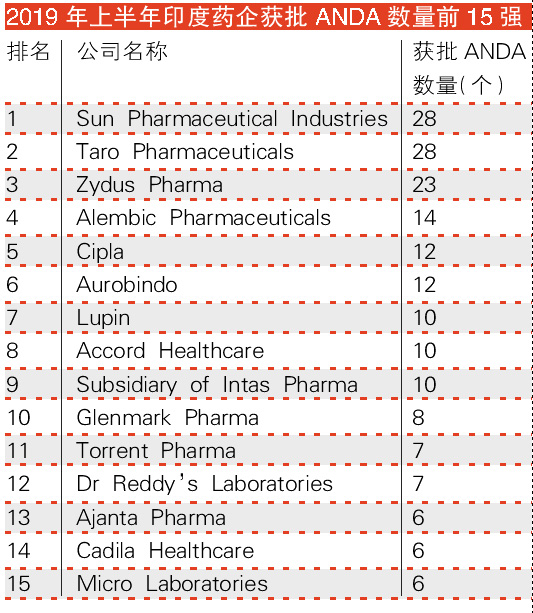
新增批文15强
研究显示,太阳制药公司(Sun)和特罗制药公司(Taro)在此期间分别获批了28个正式ANDA,并列首位。其次,齐杜斯制药公司(Zydus)获批了23个ANDA,阿莱姆比克制药公司(Alembic)获批了14个,西普拉(Cipla)和阿拉宾度制药公司(Aurobindo)各获批了12个,鲁宾(Lupin)、阿克德医疗(Accord)、因塔斯制药(Intas)子公司分别获批了10个ANDA。
紧随其后的是格伦马克制药公司(Glenmark)8个,托伦特(Torrent)和雷迪制药公司(Dr Reddy’s)各7个,阿扬塔(Ajanta)、卡迪拉医疗保健(Cadila)和密克罗制药公司(Micro)各6个。
在印度药企获批的55个暂定ANDA中,阿尔克姆(Alkem)、Glenmark和MSN制药公司各获批5个,Torrent获批6个,Zydus和Sun依次获批4个。
研发投入持续增加
印度制药公司之所以能够在ANDA申报领域保持优势,主要源于其对研发的专注。过去几年来,印度主要制药企业的研发支出持续增加。
2018-2019年,Sun研发投入达191.3亿卢比,目前共获批了453个ANDA,待批的ANDA有118个,包括13个暂定ANDA待批。2019年1-3月,Sun提交了9个ANDA申请,获批了12个。
2018-2019年,Aurobindo的研发支出达87.2亿卢比,共提交了62个ANDA申请,获批了48个。Aurobindo已累计提交了541个ANDA申请,获批了403个,包括26个暂定ANDA。
截至2019年3月底,过去一年里,Alkem制药公司的研发支出从上一年度的36.46亿卢比增至46.22亿卢比,增幅达26.77%。
有评论认为,当前,印度制药企业应进一步专注研发创新,加大研发投入,以保持未来从美国FDA继续获批更多ANDA的良好势头。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






