药械组合产品“擦边球”是否捷径?
发布时间:2019-11-05 14:41:46作者:本报特约撰稿 边界来源:医药经济报
“一类医械”此路不通,临床研究难以避免
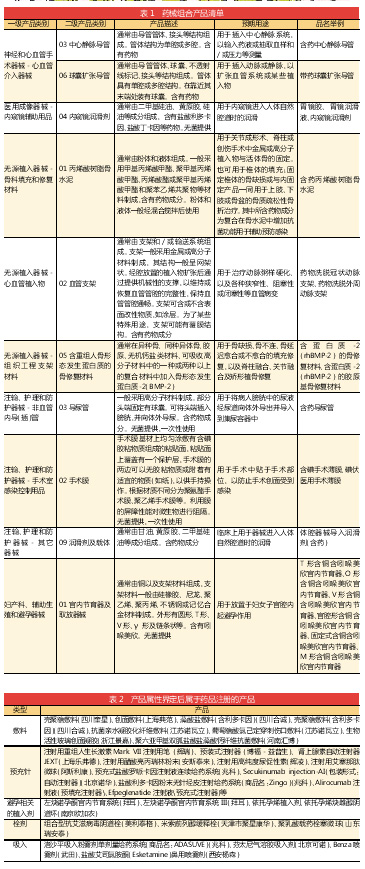
对于药械组合产品的注册申报管理越发规范。根据《药品注册管理办法》2019年版所提及的“药械组合产品注册”,拟申报注册的药械组合产品,已有同类产品经属性界定为药品的,按药品进行申报;尚未经属性界定的,申请人应当在申报注册前向国家局申请产品属性界定。
以药品作用为主的药械组合产品,需申报药品注册;以医疗器械作用为主的药械组合产品,需申报医疗器械注册。带药物涂层的支架、带抗菌涂层的导管、含药避孕套、含药节育环等产品,按医疗器械进行注册管理,含抗菌或消炎药品的创口贴、中药外用贴敷类产品等按药品进行注册管理。
那么,以注册上市程序相对简化的第一类医疗器械申报“药械组合产品”,是否一条捷径?
“正规军”
以“械”注册门槛也不低,都属三类器械
关于以医疗器械作用为主的药械组合产品,2017年9月国家药品监督管理局发布了《关于发布医疗器械分类目录的公告》(2017年第104号)。该目录与《关于药械组合产品注册有关事宜的通知》(国食药监械[2009年16号])一致,管理类别中标注了“药械组合产品”,并且都属于器械的分类“Ⅲ类”,即指植入人体,用于支持、维持生命,对人体具有潜在危险,对其安全性、有效性必须严格控制的医疗器械。
而申请第三类医疗器械注册,应当进行临床试验。并且,第三类医疗器械进行临床试验对人体具有较高风险的,应当经国家药品监督管理局批准。需进行临床试验审批的第三类医疗器械目录由国家药品监督管理局制定、调整并公布。这意味着“药械组合产品”的申报注册难度并不低。
“擦边球”
走敷料一类医械注册?不可行!
国家药品监督管理局自2017年2月起,陆续发布了13批次《关于药械组合产品属性界定结果的公告》,共有181个产品被公告。最终被认定“不属于药械组合产品,应按照药品申报”的产品主要是两类,一是敷料,二是预充针。避孕相关的植入剂、栓剂和吸入剂也有不少企业申请去做界定。
医疗器械的护理功能器械类设置了“可吸收外科敷料(材料)”、“不可吸收外科敷料”、“创面敷料”、“包扎敷料”。可吸收外科敷料(材料)包括可吸收性止血、防粘连材料。不可吸收外科敷料则包括敷料、护创材料中的医用脱脂棉、医用脱脂纱布。创面敷料包括敷料、护创材料中创口贴。包扎敷料为敷料、护创材料中纱布绷带。都是不含药用的。
上述的敷料大多数是第三类的管理类别,除了用于非慢性创面、接触真皮深层及其以下组织且所含成分不可被人体吸收的的医用敷料,管理类别由第三类降为第二类。
属于管理类别一类的敷料为包扎敷料,以及创面敷料的液体、膏状敷料和创口贴。
其中,液体、膏状敷料通常为溶液或软膏(不包括凝胶);所含成分不具有药理学作用;所含成分不可被人体吸收;非无菌提供。通常命名为藻酸银敷料、亲水性纤维含银敷料、自粘性软聚硅酮银离子有边型泡沫敷料的含银敷料,以及通常为在纱布、无纺布、水胶体、藻酸盐纤维等非液体(非凝胶)主体材料中加入硝酸银等抗菌成分的敷料,因此也是属于第三类的管理类别。
此外,透明质酸钠凝胶属于可吸收外科防粘连敷料,通常用于手术中植入体内,施加于易发生粘连的两个组织界面处,用于防术后粘连,因此也属于第三类的管理类别。
综上所述,实际上,含药贴剂类产品,想通过敷料途径走一类医械申报“捷径”,基本是不可能的,因为按一类或二类医疗器械注册的敷料基本是不含药用成分的。
★★★ 小结 ★★★
药械组合产品的注册申报管理越来越规范化。因为含有装置或者特殊材料,一些以“药”为主组合“械”的产品属于国内企业较少布局的、又具有一定门槛的产品。
从目前的管理方案来看,药械组合产品若属于药品管理,就要符合药品的上市标准。而药械组合的产品若属于器械,也是按医疗器械第三类进行管理,申报注册也要启动临床研究,不能采取打“擦边球”直接按注册上市程序相对简化的第一类医疗器械进行申报。
无论最终被认定是药品还是医疗器械,上市的临床研究大概率是跑不了的。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






