孤儿药定价方法新进展
发布时间:2019-10-24 15:16:59作者:胡善联来源:医药经济报
孤儿药定价方法新进展
全球范围内大约有3.5亿罕见病患者,这个看似极为庞大的群体,对应着7000多种罕见病,且新的病种还在不断被发现。每一种罕见病患者人数从百人到数万人不等,少数病种能达到数十万人,但只有5%的罕见病有相应的治疗药物。
统计显示,美国孤儿药定价一般为非孤儿药的6~7倍。就孤儿药来说,企业一般均有自主定价权,由于孤儿药市场需求相对较小,唯有较高的定价才能取得足够的投资回报。美国孤儿药法案给予孤儿药企业很大的自主定价权,全球最贵的药物中,几乎都是孤儿药。
2018年全球销售前10的药品中,有8个在美国获得孤儿药身份认定,其中4个药物是以孤儿药身份上市并逐渐扩展到多个罕见病或非罕见病适应证。例如,1997年利妥昔单抗获批用于治疗非霍奇金淋巴瘤,随后扩展了多个适应证;来那度胺在美国获批的所有适应证都是罕见病,且获得了孤儿药身份认定。治疗罕见病遗传性视网膜营养不良的基因药物Luxtur,能一次性治愈遗传性儿童致盲病症,其定价是每剂276万美元。目前世界上最贵的孤儿药还有Glybera,该药是由AMT制药公司研制用于治疗家族性脂蛋白脂肪酶缺乏症的基因药物,该药每剂费用超过120万美元。另外,依库珠单抗注射剂(Eculizumab,商品名Soliris)用于治疗阵发性夜间血红蛋白尿(PNH)和非典型溶血性尿毒症综合征(aHUS),每年花费超过50万美元。Evaluate Pharma统计显示,2016年罕见病患者平均医疗投入为每人年14.04万美元。
经典的超罕见病极为罕见。在美国,超罕见病指患者人数不到1万人的疾病,在欧盟为患病率低于1:50000的疾病。超罕见病缺乏有效的诊断和及时的治疗,特别是在孤儿药发展的早期阶段,此时的商业模式是鉴别罕见病患者,通过接触罕见病患者组织的机会让企业介入,同时鼓励研发,给予孤儿药高定价。例如健赞公司从上世纪80年代发起对戈谢氏病的关注,提高医师和患者群体对该病的知晓率,为孤儿药的市场提供了坚实的基础。
孤儿药定价原理及方法
一种是成本加成法;另一种是以价值为基础的定价方法,这已成为很多发达国家创新药定价的金标准
在刚刚过去的2019国际卫生技术评估大会上,德国学者Gandjour Afschin提出创新药物的两种基本定价方法:一是成本加成法(Cost plus pricing,CPP),另一种是以价值为基础的定价方法(Value-based pricing,VBP)。后者在很多发达国家已成为创新药物定价的金标准,但目前孤儿药的补偿价格还是以成本加成定价方法为主。研发成本大部分要分摊到用药人数上,而孤儿药的成本往往要比合理的利润更高。孤儿药的定价如何去应用增量成本效果的阈值的价值定价方法,仍是值得进一步研究的问题。
按照贝叶斯收缩估计公式(Bayesian Shrinkage estimation),孤儿药价格=(σ2VBP/σ2VBP+σ2CR&D)CPP+【1- σ2VBP/(σ2VBP+σ2CR&D)】VBP
σ2=平均值的变异数=S2/n;CR&D=孤儿药的研发费用;CPP=(CR&D /n)×m,m=边际利润的百分比。
如果不考虑效益,孤儿药会有医保支付,每个罕见病患者支付的价格由成本加成来定价(CPP),也就是按(CR&D / n)×m。如果研发费用为10亿欧元,全球有1000个患者治疗,则平均价格≈CR&D/1000×m;m≈100万欧元×m。
反之,如果只有1个患者治疗,并获得收益,价格则由按贝叶氏权重CPP+VBP的平均值决定,随着证据的增加,孤儿药的定价趋向于按价值(VBP)定价。
例如:某制药公司研发费用花费10亿欧元,全球有1000例患者治疗,则平均价格为10亿欧元被1000例除,平均每例成本加成(CPP)的药品定价为100万欧元×m。如果只有1例治疗价格为CPP+VBP的平均值,随着健康治疗效益的增加,药品价格权重趋向于VBP。
第一种情景是如果效益在n个病人中能够量化的话,则σ2 VBP=σ2 CR&D / (ntrial+1)=(1/ntrial+1)/(1/ntrial+1)×CR&D / ntotal=1/ntrial×CR&D / ntotal=1/CR&D=R&D的成本权重能随着ntrial ntotal而减少。
第二种情景是效益在n个病人中不能量化,则=1/(1+1)×CR&D/ntotal=CR&D/2ntotal=R&D的成本权重能随着2ntotal而减少。
孤儿药定价应用举例:
背景资料为CR&D=10亿欧元,VBP=5万欧元,健康效益=每年1个单元。
第一种情景是ntotal=10000例,量化的效益为(ntrial=100);CR&D/ntrial ntotal=10亿欧元/100万=1000
孤儿药的价格=1000+【1-(1/ntrial)】50000≈51000
第二种情景是ntotal=10000例,但效益不能量化(ntrial=10,000);CR&D / 2ntotal=10亿欧元/20000=50000
孤儿药的价格=50000+(1-1/2)50000 =100000 (与成本加成的价格CPP相同)
如果药企已经知道他们的成本可以覆盖的话,则他们没有积极性去提高R&D效率。为了避免这种负向的激励机制,成本加成的定价方法可以基于企业平均的研发成本。研发的费用也可根据研发的成功率而调整,但往往孤儿药的成功率是比较高的。
当决策避免研发风险时,需要接受一个风险溢价(risk premium,RP)以补偿研发的失败的不确定性。1964年Pratt 曾提出以下计算公式:CR&D-【RA(CR&D)】 / 2×σ2(CR&D)。由于效率不高R&D的成本可能要2倍,2σ=CR&D,σ=1/2 CR&D,假设RA=2,则RP=1/4 CR&D。
总之,一个新的孤儿药物定价的复合模型能够解释孤儿疾病的小目标人群,并可相应地调整基于价值的定价。价格取决于健康效益是否可以量化。研发成本的权重随着试验人数和总人数或2倍总人数而减少。孤儿药的研发总成本可分配到不同国家,根据人均国内生产总值和患者人数。所以,孤儿药成本加成的定价方法因不同国家的情况而不同。
高特技术定价差异明显
各国对孤儿药推荐的情况是不一致的,建议今后孤儿药生产企业在提交审批材料中增加经济学评价资料,包括成本效用信息
英国提出了高特技术的定价标准,2017年NICE提出改变高特技术的定价系统。所谓的高特技术(high specific technology,HST),按照英国NICE的定义,是指能够治疗慢性和失能状况的少数病例的方法技术。病例组需要符合下列条件:1.极少数中心能够治疗的少数病例;2.具有特殊的临床原因。治疗慢性和严重失能状况的情况是指专门用于:1.非常特殊的服务环境中;2.通常具有很高的购买费用;3.可能需要终生使用;4.这项技术需要国家来决定是否能够报销。
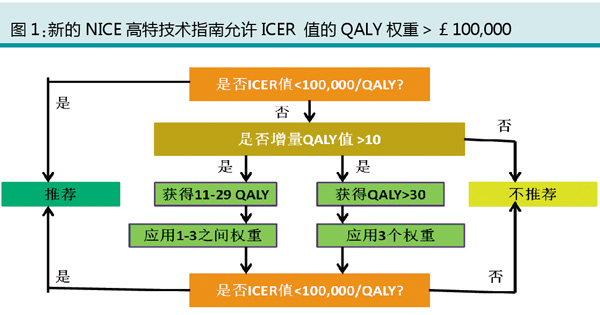
2017年4月以前,NICE提出的只是高特技术定性的标准,如疾病的严重情况、未满足的需要、临床的效益;2017年4月以后,NICE提出了一些定量的标准:如(1)病情的性质;(2)临床的效果;(3)货币的价值即每成本效果增量的阈值(ICER)应为每QALY100,000英镑;(4)如果ICER值大于10QALY,则需给予附加的QALY权重;(5)技术的影响已超出了直接的健康效益。
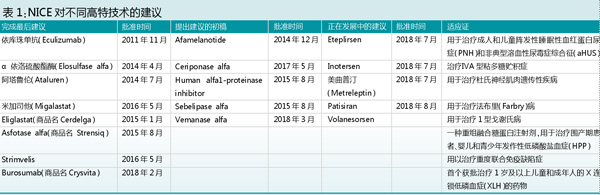
在NICE网站上可以查阅到2013-2018年间有关高特技术的信息,包括增量成本效果比值(ICER),获得的增量QALY值以及权重和建议。迄今已有8项特高技术提出了最后的建议,有6项提出了建议的初稿,有5项正在发展中,具体药品见表1。
高特技术的评价方法是否对超孤儿药是最好的模式?超孤儿药治疗的超罕见病一般是指患病率小于1/50000。由于治疗的价格很高难以取得补偿。从2013年起,NICE用高特技术的评价标准来对待超孤儿药。其定义是目标病人很少,只有在少数的临床中心可以治疗,其次这类疾病均在慢性疾病和严重失能的疾病。需要满足以下三个条件:(1)专门用于高度专业化的服务;(2)可能是非常高的购买成本;(3)需要终身治疗的可能。这项技术在全国范围内的需求是巨大的。其评价的框架是:(1)情况的性质;(2)临床效果;(3)货币的价值,ICER值为<100,000英镑/QALY,附加的QALY权重,如果>10个增量QALYs;(4)技术的增量影响超过直接的健康效益。
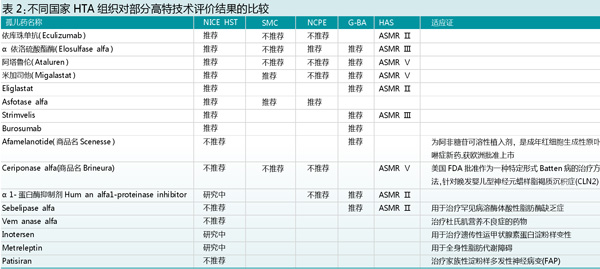
表2提示英国NICE的高特技术指南与有关国家的药物经济学指南比较的结果(包括法国的HAS、苏格兰的SMC、德国的G-BA、荷兰的NCPE)。在比较了2013年1月- 2018年11月16种孤儿药评价的结果后,发现各国对孤儿药的推荐的情况是不一致的。因此,建议今后孤儿药生产企业在提交审批材料时补充经济学评价的资料,包括成本效用的信息(ICER值)。
据报道,超孤儿药合理的定价应采用10年的药品价格和增量QALY值来评价。如对侧索肌肉萎缩症I型 (SMA)的基因治疗,通过线性回归来估计市场价格。收集8个超孤儿药的价格信息,包括非典型性溶血性尿毒症、淀粉样变性疾病、低磷酸脂酶症、法布雷氏病、戈谢氏病I型、血友病A、粘多糖病IV型和SMA I型。这8个疾病在美国的患病人数在900~5400人。而这些超孤儿药与标准疗法比较能取得的增量QALY值为0.98~25.22,而10年的药品成本大约在240万~510万美元。一个增量QALY估计为63723 美元,根据回归曲线估计为400万美元。
预告>>
2020年国际卫生技术评估年会(HTAi)将于2020年6月20-24日在北京召开,本次会议将由卫健委卫生发展研究中心和复旦大学卫生技术评估中心共同筹备。在2019年HTAi年会上,赵琨教授和陈英耀教授就2020年HTAi的简况做了介绍,并盛情邀请各国专家和专家参会。据悉,2020年HTAi年会的主题是:“在一个不断变化的世界中,卫生技术评估在实现和维持可持续卫生保健系统中的作用”。本报将对此次会议进行详细报道,敬请关注。

此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






