“吸入剂”新规抬高仿制门槛 仿制热点投资需谨慎
发布时间:2019-10-08 17:11:14作者:本报特约撰 边界来源:医药经济报
8月2日,CDE官方网站发布关于公开征求《经口吸入制剂仿制药药学和人体生物等效性研究指导原则》意见的通知。这是首次针对经口吸入剂出台指导原则,预计还会针对近期其他研发热点,出台相关的仿制药技术指导原则。
经口吸入制剂(Orally Inhaled Drug Products,OIDPs),是指通过吸入途径将药物递送至呼吸道和/或肺部,以发挥局部或全身作用的制剂。主要用于呼吸系统疾病以及其他疾病的治疗。经口吸入剂指导原则主要适用于如哮喘、慢性阻塞性肺疾病(Chronic Obstructive Pulmonary Diseases,COPD)等呼吸系统疾病用经口吸入制剂。
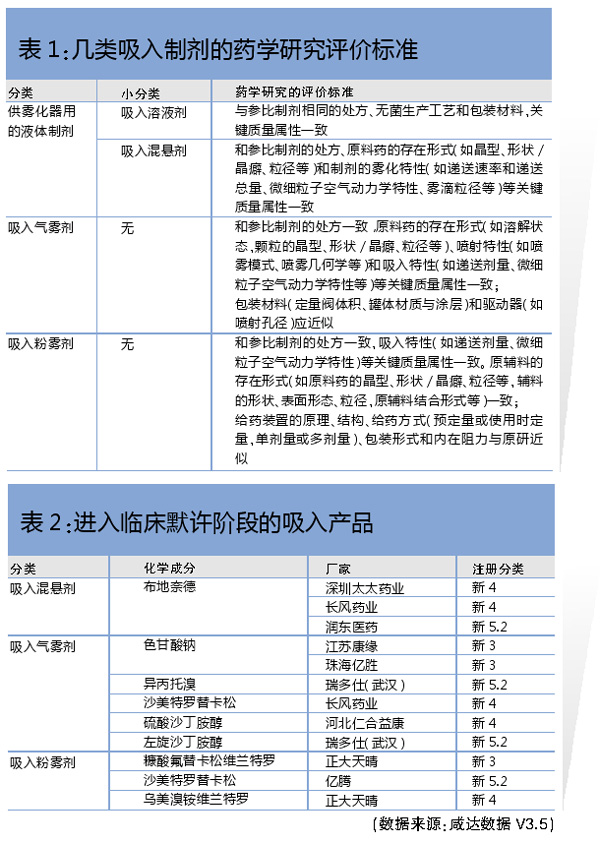
指导原则将经口吸入制剂分成三类:供雾化器用的液体制剂、吸入气雾剂和吸入粉雾剂。其中,供雾化器用的液体制剂又分为吸入溶液剂和吸入混悬剂。
总体来看,在此指导原则下,投资热点“吸入剂”的仿制门槛将大为提高,从而成为高技术门槛的一类药物。
药学研究一致性
生产工艺、包装材料“大考”
分类标准细则:
强调处方和原料药存在形式一致
药学研究方面,无论是哪类经口吸入制剂,都要求仿制药和参比制剂的处方完全一致。除了吸入溶液剂以外,其余的分类都要求和原料药的存在形式(如晶型、形状/晶癖、粒径等)关键质量属性一致。
吸入粉雾剂更是要求辅料的形状、表面形态、粒径,以及原辅料结合形式都与参比制剂一致。这意味着经口吸入制剂的仿制药必须对原研产品进行逆向工程研究。
吸入溶液剂更关注无菌生产工艺、包装材料与参比制剂相一致。其余分类则更关注吸入特性(如递送剂量、微细粒子空气动力学特性等)与参比制剂相一致。这是因为吸入溶液剂最终的产品形态以及生产方式与无菌注射液类似,国内实际临床应用上也经常将一些无菌注射液当作供雾化器用的液体制剂来使用,例如氨溴素。
重视包装材料批间差异:
设置稳定性考察
由于吸入气雾剂和吸入粉雾剂都是带装置的,生产工艺较为复杂,包装材料批间差异都可能对产品质量产生影响。鉴于此,CDE指导原则要求对不同包装材料和包装系统选择合适的稳定性试验条件,按照稳定性研究技术指导原则和参比制剂说明书进行稳定性考察。
参比制剂批间差异要求:
需避开差异大的品种
CDE指导原则要求质量特性对比研究,应选用至少3批仿制制剂和3批参比制剂用于研究,并推荐使用统计学方法进行质量特性相似性比较。这实际上暗示了,即使是参比制剂,也可能存在批间差异较大的情况。
指导原则对于参比制剂药学性质差异较大的品种,还要求申请人提交详细的研究资料,以证明在符合化学药品注册分类要求的前提下,这些差异对仿制制剂与参比制剂的生物等效性不产生影响。这基本堵死了参比制剂药学性质差异较大的药品的仿制。
人体研究一致性
哪些门槛抬高?哪些注意事项?
临床投入一向是国内企业视为项目是否值得投资的一个重要标准。
对于吸入溶液剂,如证明与参比制剂药学质量一致,通常不再要求进行人体生物等效性研究。这也基本与无菌注射剂仿制药的临床标准相一致。预计将吸引更多人投资吸入溶液剂。
而吸入混悬剂、吸入气雾剂、吸入粉雾剂都需要进行人体生物等效性研究。根据CDE指导原则,需要开展的人体生物等效性包括药代动力学研究(PK-BE研究)、药效动力学研究(PD-BE研究)/临床终点研究两部分。
1.PK-BE研究
PK-BE生物等效的接受标准为:PK参数几何均值比值的90%置信区间应在80.00%~125.00%范围内。企业若只想投入PK-BE研究(而不投入PD-BE/临床终点)来评价人体生物等效性,就需要开展充分的研究证实该仿制品的药代动力学和局部递药等效性之间具有线性关系。
对已知活性成分的固定剂量复方制剂,在PK-BE研究中应分别证明复方中每种活性成分的PK-BE。对于需要进行人体生物等效性研究、且存在多个规格制剂的,CDE指导原则建议每个规格均进行PK-BE研究。
2.PD-BE/临床终端
PD-BE研究最主要针对的是支气管扩张剂(包括短效β2受体激动剂/SABA、长效β2受体激动剂/LABA和抗胆碱能药物)。值得注意的是,如果PK参数几何均值比值的90%置信区间不在80.00%~125.00%范围内,需进行最大推荐剂量给药的PD研究,评估安全性。鉴于PD-BE研究设计的复杂性,CDE指导原建议,若申请人采用PD-BE试验设计,最好事先与监管机构沟通。
临床终点研究则主要针对吸入性糖皮质激素(Inhaled Corticosteroid,ICS),或其他采用临床终点研究评价人体生物等效性的制剂,而且最好进行随机、双盲、阳性药平行对照的试验设计,证明受试制剂非劣效于参比制剂。此外,含激素药物试验中,还需要同时监测激素对下丘脑-垂体-肾上腺轴(HPA轴)的影响,证明受试制剂对HPA轴的影响不大于参比制剂。对于适应症同时包括哮喘和COPD的产品,只要证明对哮喘治疗的等效性,可类推于COPD,故可同时获得2个适应症。
对已知活性成分的固定剂量复方制剂,PD-BE/临床终点研究时应综合考虑所有活性成分的有效性。对于需要进行人体生物等效性研究、且存在多个规格制剂的,PD-BE/临床终点研究应考虑所有申报规格均进行临床研究。
注册和上市情况
仅有“吸入溶液剂”上市,已趋热
根据新注册分类,2019年起才有符合一致性评价要求的经口吸入制剂仿制药获批,分别是以新4类申报的深圳太太药业的吸入用复方异丙托溴铵溶液,以及以5.2类申报的韩美的吸入用盐酸氨溴索溶液。以化学药品旧注册分类申报,但视同通过一致性评价获批上市的仅一个产品,为恒瑞的吸入用地氟烷,2018年获批上市。
由此可见,目前符合仿制药一致性评价标准国内获批上市的经口吸入制剂仿制药都是吸入溶液剂,暂无吸入混悬剂、吸入气雾剂、吸入粉雾剂符合仿制药一致性评价标准上市。
吸入混悬剂、吸入气雾剂、吸入粉雾剂预计都需要根据CDE临床指导原则进行临床研究。吸入混悬剂最热的产品是布地奈德。吸入气雾剂是最多化学成分申报的分类。吸入粉雾剂则以复方制剂为主,由于含有激素,预计都需要启动临床终点研究,正大天晴主要布局的是吸入粉雾剂。
★★★ 小结 ★★★
吸入制剂作为技术门槛较高的产品,吸入溶液剂已经趋热,吸入混悬剂布地奈德也是国内企业研究的热点产品,门槛较高的吸入粉雾剂目前尚未有通过一致性评价的产品获批。
CDE指导原则的发布,给国内仿制药企业指明了方向。其中,要求吸入制剂要做到药学和临床有效性和安全性与参比制剂一致,难度非常高。短期内,只有生产工艺、包装材料都过关的“高级玩家”才能瓜分市场。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






