一大批晚期成熟项目排队上市 单抗研发新赛道新特质
发布时间:2019-09-30 16:49:19作者:李勇来源:医药经济报
一大批晚期成熟项目排队上市
单抗研发新赛道新特质
自20世纪90年代中期以来,抗体药物已逐渐发展成为临床和商业上最为成功的药物类别之一,目前超过60种单克隆单抗(mAb)被全球主要监管机构批准用于治疗各种疾病,主要是在肿瘤学、自身免疫和慢性炎症疾病领域。
2018年,美国FDA和欧洲EMA更是创纪录地批准了13种单抗。其中,非癌症适应症单抗获得上市批准的占比更高(占77%),并且涉及许多新的适应症。
非癌适应症:权重更大
不限于免疫疾病,用于多种治疗领域
临床开发中的单抗用于多种治疗领域,如癌症、心血管/止血、免疫介导的疾病和骨/骨骼疾病,部分已进入寻求上市批准阶段。
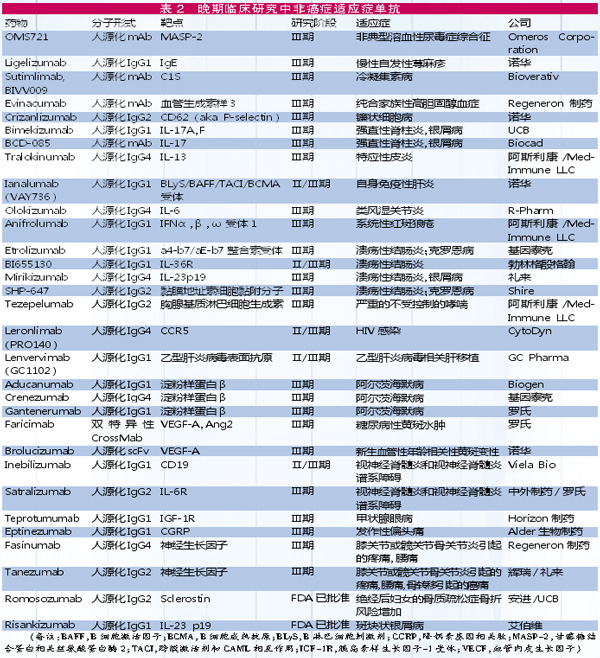
在非癌症适应症领域,除了近期获得FDA批准的2种单抗(Romosozumab,Risankizumab)外,还有29种新型单抗治疗药物正处于晚期临床研究阶段。此外,有3种已经进入监管审查阶段,并且至少4种可能在2019年底前递交上市申请。
今年上市或已申请上市
◎Romosozumab 今年4月9日,安进/UCB合作开发的这个靶向于硬化蛋白(sclerostin)的人源化IgG2单抗获得FDA批准,用于治疗骨折风险升高的绝经后女性骨质疏松症。该药于2016年就向FDA提交了生物药许可证申请(BLA),但FDA要求提供额外的安全性和有效性数据,2018年7月重新提交BLA后经第二轮审查后获得批准。目前,该药还在欧盟提交上市申请。
◎Risankizumab 今年4月,艾伯维开发的这个新药同时获得FDA和EMA批准,用于治疗斑块状银屑病。该药与近年获批的Tremfya(guselkumab,强生,2017年获批)和Ilumya(tildrakizumab,太阳制药,2018年获批)靶点相同,都是靶向于IL-23p19。
◎Eptinezumab 今年2月,Alder向FDA提交该药预防偏头痛的BLA。该药与去年获得批准上市的Emgality(galcanezumab-gnlm,礼来)和Ajovy(fremanezumab-vfrm,梯瓦)一样,都是靶向于CGRP配体。Eptinezumab的主要优势是每3个月给药一次。
◎Leronlimab 今年3月,CytoDyn公司开发的这个具有多种治疗适应症潜力的趋化因子受体5(CCR5)进入FDA审查阶段。CytoDyn计划以滚动方式提交其BLA。Leronlimab是一种人源化IgG4单抗,皮下注射以阻断HIV-1进入和感染免疫细胞。
◎Brolucizumab 今年4月,FDA受理了诺华这个人源化scFv靶向血管内皮生长因子A的新一代眼科药物的BLA,用于治疗湿性年龄相关性黄斑变性(wet-AMD)。值得一提的是,诺华使用了一张优先审评券(PRV)加速该BLA审查,将把审查周期由常规的10个月缩短至6个月。如果获得批准,预计将在2019年推向市场。
年底前或提交上市申请
◎Teprotumumab 是由Horizon制药开发的靶向胰岛素样生长因子-1受体人源化IgG1单抗,用于中度至重度甲状腺眼病,该病通常与Grave病(甲亢)有关。预计该药在2019年中期提交BLA。此前,FDA已授予其突破性药物资格、孤儿药资格、快速通道资格。
◎Crizanlizumab 由诺华开发,已在美国和欧盟被授予治疗镰状细胞相关疼痛的孤儿药物资格,预计在2019年提交BLA。
◎Satralizumab 为日本中外制药/罗氏开发的人源化抗白细胞介素-6(IL-6)受体单抗,用于视神经脊髓炎谱系障碍(NMOSD)的治疗,已获得美国和欧盟孤儿药物资格,预计将于2019年提交BLA。
◎Tanezumab 由辉瑞/礼来合作开发,是阻断神经生长因子(NGF)的人源化抗NGF IgG2单抗,目前已在骨关节炎疼痛、癌症疼痛和慢性腰背疼痛患者中开展晚期临床研究。Tanezumab被FDA授予快速审评通道资格,用于治疗骨关节炎疼痛和慢性腰痛,预计将在2019年提交BLA。
癌症适应症:青睐实体瘤
抗体偶联药、实体瘤、多适应症研究
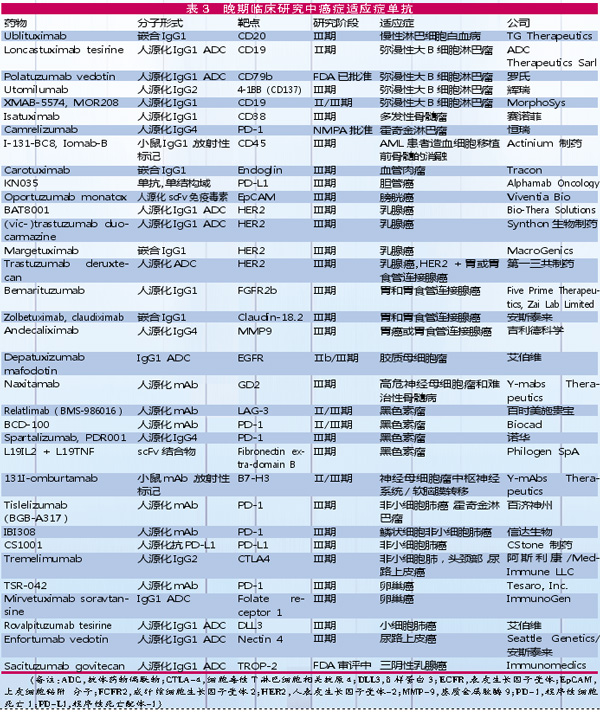
目前,有34种癌症适应症的新型单抗药物进入晚期临床研究阶段,多种单抗已经或计划在2019年提交上市申请。
有三个特点值得关注:一是有10个抗体偶联药物(ADC);二是实体瘤研发项目占明显优势(超过80%);三是有不少单药涉及多个适应症的项目。
◎Polatuzumab vedotin 是罗氏开发的人源化抗CD79bIgG1抗体,于今年6月获得FDA批准,与苯达莫司汀和利妥昔单抗联合使用,治疗难治的弥漫性大B细胞淋巴瘤成人患者。该药是与抗有丝分裂剂Monomethyl auristatin E(MMAE)结合的ADC,为靶向B细胞表面特异的CD79b蛋白与化疗药物的连接。
◎Isatuximab 为赛诺菲开发的抗CD38 IgG1嵌合单抗药物,用于治疗复发难治性多发性骨髓瘤(MM)的关键Ⅲ期研究达到改善无进展生存期(PFS)的主要终点。该药已被美国和欧盟授予治疗MM的孤儿药资格指定,赛诺菲计划今年底提交上市申请。
◎Spartalizumab 为诺华开发的人源化抗PD-1免疫疗法,以亚纳摩尔亲和力靶向结合PD-1,阻断其与PD-L1/PD-L2的相互作用。目前正在评估多种类型肿瘤,包括黑色素瘤、神经内分泌肿瘤、鼻咽癌、非小细胞肺癌、三阴性乳腺癌、肝细胞癌和结直肠癌。诺华计划于2019年提交其与trametinib+dabrafenib联合治疗转移性BRAF V600+黑色素瘤的BLA。Spartalizumab已被FDA授予用于治疗神经内分泌肿瘤孤儿药物资格。
◎MOR208 为MorphoSys公司开发的靶向于CD19的人源化Fc工程化单抗。MOR208被证明能诱导由自然杀伤细胞介导的白血病细胞裂解,已被欧盟和美国授予孤儿药资格,用于治疗慢性淋巴细胞白血病(CLL)。FDA还指定其用于治疗弥漫大B细胞淋巴瘤(DLBCL)的突破性疗法和快速审查通道。
◎Oportuzumab monatox 由Viventia Bio开发,为靶向于上皮细胞粘附分子(EpCAM)的重组人源化抗体scFv+铜绿假单胞菌外毒素A的ADC。2005年8月被美国和欧盟授予孤儿药资格,并且FDA对其治疗非肌肉浸润性膀胱癌(NMIBC)授予快速审查通道指定。该药有望于2019年底之前提交BLA。
◎TSR-042、enfortumab vedotin、ublituximab TESARO正在开发的抗PD-1单抗TSR-042用于治疗多种癌症。Seattle Genetics/安斯泰来Enfortumab vedotin(ASG22ME)是靶向于nectin-4的抗体偶联物,用于治疗局部晚期或转移性尿路上皮癌,已获得FDA突破疗法认定。TG治疗公司开发的糖基化工程抗CD20抗体Ublituximab目前正在进行癌症(CLL\非霍奇金淋巴瘤)和非癌症(多发性硬化)适应症的5项晚期临床研究。这些药物都有可能会在今年提交监管审查。
延伸<<
中国,后起之秀走到前排
十年前,单抗药物的开发主要在美国或欧盟等发达地区。如今,我国生物制药行业在抗体临床开发方面取得了长足进步。目标已不仅限于中国,而且在全球范围内通过与跨国大型制药公司合作获得营销许可。
2018年,在我国也有2种单抗首次批准上市(君实生物的特瑞普利单抗、信达生物的信迪利单抗)。另外,我国公司有多种PD-1抗体进入晚期研究和监管审查。
百济神州于2018年8月向NMPA提交了Tislelizumab(BGB-A317)用于治疗复发或难治性霍奇金淋巴瘤的新药上市申请。该药对非小细胞肺癌、肝细胞癌和食道鳞状细胞癌的研究已进入Ⅲ期临床阶段。
信达生物与礼来正联合开发Sintilimab(IBI308),于2018年4月在国内提交治疗复发难治性经典霍奇金淋巴瘤上市申请并获得优先审评。其他正在开发的适应症还包括非鳞状非小细胞肺癌。
江苏恒瑞于2018年4月向NMPA提交了Camrelizumab(SHR-1210)治疗复发/难治性经典霍奇金淋巴瘤上市申请,并于今年5月获得批准上市,产品名为“艾立妥”(注射用卡瑞利珠单抗,Camrelizumab for Injection)。另外,恒瑞还在与Incyte公司合作对此药进一步开发。Camrelizumab正在进行其他癌症适应症研究,如非鳞状非小细胞肺癌、肝细胞癌、胃癌或食管胃交界癌、鼻咽癌、食管癌等实体瘤。

此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






