双轮驱动 辉瑞预计年均增速2%
发布时间:2019-09-27 14:07:15作者:李勇来源:医药经济报
双轮驱动 辉瑞预计年均增速2%
辉瑞未来几年的业绩主要受到抗乳腺癌药物Ibrance(palbociclib)和全球最畅销疫苗Prevnar 13的双轮驱动。未来几年,辉瑞的销售额将以年均2%的速度增长。
分析人士预计,Ibrance将呈现良好的增长势头,全球销售额将从2017年的31.3亿美元增加到2024年的82.8亿美元,年平均增长率达15%。在辉瑞的产品线中,紧随Ibrance之后的是Prevnar 13,预计其销售额将保持平稳的发展态势,到2024年达到约57亿美元。
业绩增长支柱补充
Evaluate Pharma指出,除了Ibrance和Prevnar,辉瑞的抗癌药Bavencio(avelumab)及免疫学药物Xeljanz (tofacitinib,托法替布)和Eucrisa(crisaborole)将在未来几年成为其业绩增长的重要支柱。生物类似药也将举足轻重,辉瑞在该业务上的收入大部分来自于其在2015年以150亿美元收购的Hospira公司获得的英夫利昔单抗生物类似药。
与此同时,辉瑞已经将疫苗业务作为未来发展战略的重要组成部分。辉瑞正在推进开发一个20价肺炎链球菌偶联(20vPnC)疫苗PF-06482077,旨在跟进Prevnar 13的步伐。
10个药物销售额过10亿元
根据辉瑞公布的2018年财报,2018年公司收入536亿美元,同比增长2%,其中10个药物销售额达10亿美元以上。Ibrance销售额为41.18亿美元,同比增长32%;Prevnar 13销售额为58.02亿美元,同比增长4%;Xeljanz销售额为17.74亿美元,同比增长32%。Lyrica(pregabalin,普瑞巴林)销售额为49.7亿美元,同比降低2%。与百时美施贵宝合作开发的Eliquis (apixaban,阿哌沙班)销售额为34.34亿美元,同比增长36%。
26项新分子项目
辉瑞关注的主要疾病领域包括:肿瘤、罕见疾病、感染疾病、心血管和代谢疾病。
从辉瑞2019年公开的研发线来看,与2014年相比,辉瑞处于临床试验Ⅱ期及更晚期新分子项目略微减少(分别为26项和31项),而新适应症项目却在翻倍(分别为35项和17项)。同时,辉瑞在研的5个生物类似药中有4个也进入上市申请审评中。
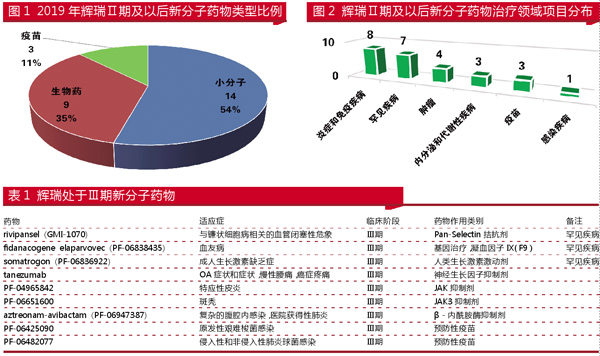
根据2019年辉瑞公开的公司研发项目来看,处于临床试验Ⅱ期及更晚期新分子项目(26项)包括:小分子项目14项(占54%),生物药项目9项(占35%),疫苗项目3项(占11%)。
26项新分子项目中,以研究阶段来看:正在审评5项(占19%),Ⅲ期9项(占35%),Ⅱ期12项(占46%)。
26项新分子项目中,以治疗领域来看,免疫和炎症项目最多为8项,罕见疾病项目也达7项,肿瘤项目4项,内分泌和代谢性疾病、疫苗同样为3项,感染性疾病项目1项。
在审评项目
辉瑞2018年共有4个新分子实体药物获得美国FDA批准上市,成为当年新药获批的最大赢家。从目前辉瑞公布的新药申请审评项目看,其重点是让这些药物及以前获得FDA批准的药物在欧盟等其他监管机构批准上市(6项)。同时,辉瑞也在推动4个生物类似药在美国申请上市。
1.crisaborole (PF-06940799)
最早由Anacor制药公司(现被Pfizer收购)研发,是一个新型的非甾类磷酸二酯酶4 (PDE-4)抑制剂,用于2岁及以上患者的轻度至中度过敏性皮炎的局部治疗,于2016年12月14日获得FDA批准上市。目前该药正在欧盟提交上市申请。
2.dacomitinib (PF-00299804,达克替尼)
作为一线EGFR激活突变体非小细胞肺癌治疗药物,于2018年获得FDA批准,并于今年1月在日本获批上市。目前该药正在欧盟提交上市申请。
3.lorlatinib (PF-06463922)
于2018年分别在美国和日本获得批准上市,目前正在欧盟申请治疗间变性淋巴瘤激酶(Alk)阳性非小细胞肺癌二线药物适应症上市申请。
4.talazoparib (MDV3800)
是BRCA突变转移性乳腺癌治疗药物,于2018年在美国获得批准上市,目前正在欧盟提交上市申请审评中。
5.tafamidis meglumine
是转甲状腺素蛋白相关家族性淀粉样多发性神经病治疗药物,已于2011年和2013年分别在欧盟和日本获得批准上市,但至今尚未在美国上市。今年1月,辉瑞宣布,FDA已经接受tafamidis meglumine的新药申请(NDA)。本次NDA包括两种剂型,分别为tafamidis的葡甲胺(meglumine form)剂型和游离酸(free acid form)剂型。其中,葡甲胺剂型(20毫克胶囊)获得了FDA颁发的优先审评资格;游离酸剂型(61毫克胶囊)有望在2019年11月前得到批复。
6.Xeljanz (tofacitinib,托法替布)缓释片(11mg)
已经在美国获得批准上市,辉瑞正在欧盟提交该剂型上市申请审评中。
值得关注的是,辉瑞有4个生物仿制药已经在美国提交上市申请,正在审评中,它们是:PF-05280014(Herceptin,曲妥珠单抗生物类似药)、PF-05280586(Rituxan /MabThera,利妥昔单抗生物类似药)、PF-06439535(Avastin,贝伐单抗生物类似药)和PF-06410293(Humira,阿达木单抗生物类似药)。
另外,辉瑞还有9个新分子药物处于临床Ⅲ期研究阶段,有望在未来几年陆续申请上市。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






