剖析年度药审报告五大焦点 揭秘企业立项新趋势新方向
发布时间:2019-09-18 15:57:04作者:本报特约撰稿 边界来源:医药经济报
CDE每年的审评报告都可以透视出企业的申报新趋势。2019年7月CDE正式公布2018年药品审评报告。以大数据解析这个官宣报告,将为企业立项带来哪些启示?
生物药注册申请量新高,
焦点1:
生物药注册申请量新高,中国生物药时代来临?
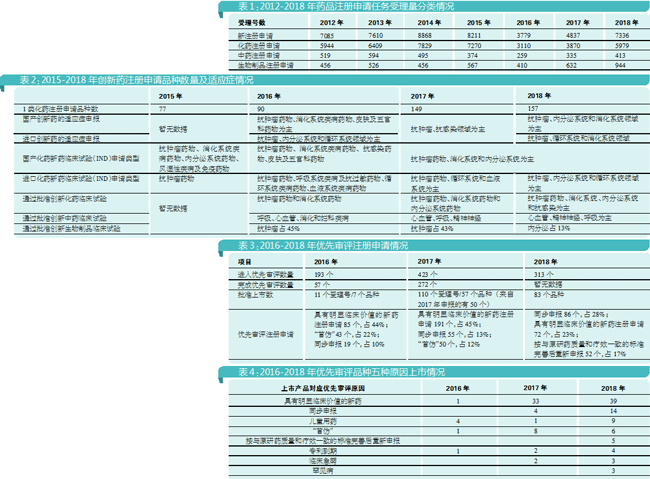
2018年注册申请任务受理量大幅增长(较2017年增长47%),且中药、化药和生物制品各类药品注册申请任务受理量均有较大幅度增长(较2017年分别增长30%、50%和42%)。不过,回顾2012年至2018年数据,2018年的注册申请总数仍然没有回到2014年和2015年的高峰期,特别是化药。
值得注意的是,生物制品达到了历年来的高峰,由此可见国内企业都在往生物制品布局。这是否意味着中国生物药时代来临,仍待观察。
焦点2:
积压问题解决到什么程度?2019年呢?
药品审评任务积压在2015年最高峰时超过22000个。那么到2018年,积压问题解决到什么程度呢?
2015年,药审中心全年完成审评任务9601件,因此到2015年底药品审评任务积压减为不到17000个。
2016年,药审中心完成审评并呈送总局审批的注册申请共12068件,因此到2016年底排队等待审评的注册申请进一步降至近8200件。
2017年,药审中心完成审评审批的注册申请共9680件,其中完成审评的注册申请8773件,完成直接行政审批(无需技术审评,下同)的注册申请907件。到2017年底,排队等待审评的注册申请降至大约4000件。
2018年,药审中心全年完成审评审批的注册申请共9796件,其中完成需技术审评的注册申请7988件(包含4052件需技术审评的行政审批任务),完成直接行政审批的注册申请1808件。因此,到2018年底,排队等待审评审批的注册申请已降至3440件。
由此可见,2018年的积压消化速度基本与2017年持平。但是,积压情况与申报数量相关,如果2019年申报数量回归到2014年和2015年的高峰,那么2019年的积压数量可能仍然会在3000件左右。
焦点3:
1类新药上市速度越来越快,哪些领域更热?
从2018年CDE的数据来看,1类新药申报整体增长显著,1类化学药的注册申请品种数也逐年上升。
从1类新药上市申请看,无论是化药、中药还是生物制剂都是倍数化增长。2018年,药审中心受理1类创新药的新药上市申请(NDA)25个品种,较2017年增长150%;受理1类化药创新药NDA 16个品种,较2017年增长100%;受理1-6类中药新药NDA 8个品种,较2017年增长7倍;受理1类生物制品NDA 9个品种(包括预防用生物制品2件,治疗用生物制品9件,共涉及11件受理号),较2017年增长4.5倍。
抗肿瘤药是近几年化学药和生物制品创新药申报的最热门领域,内分泌系统、循环系统和消化系统领域也相对较热。中药则是心血管和呼吸系统用药相对较热。
焦点4:
优先审评“五种原因”,哪些更利好?
值得关注的是,进入优先审评目录后上市成功的产品数越来越多,从2016年的7个品种上升到2018年的83个品种。
CDE从2015年起逐步完善有关药品注册申请的优先审评制度,积极探索对高质量仿制药和临床急需仿制药实行优先审评。2015年,CDE起草了《临床急需儿童用药申请优先审评审批品种评定的基本原则》,并上网征求意见。
2016年发布《关于解决药品注册申请积压实行优先审评审批的意见》(食药监药化管〔2016〕19号,以下简称19号文),加快具有临床价值和临床急需药品的研发上市,对创新药、儿童用药、临床急需药、专利到期药和“首仿”实行优先审评,制定各类优先审评品种的遴选原则和具体工作程序。2016年当年就依程序先后发布12批优先审评目录。
新药获得优先审评的理由主要涉及具有明显临床价值的新药注册,仿制药则涉及“同步申报”和“首仿”。其中,“同步申报”是指19号文优先审评审批范围(一)中第5种情形,即“申请人在美国、欧盟同步申请并获准开展药物临床试验的新药临床试验申请;在中国境内用同一生产线生产并在美国、欧盟药品审批机构同步申请上市且通过了其现场检查的药品注册申请。”
此外,还值得注意的是2015年因“722”而退市的产品,当时的政策是按与原研药质量和疗效一致的标准完善后可以重新申报并且获得优先审评。2018年,这类产品共有52件申报。
2018年获批的83个优先审评品种中,优先审评原因是“具有明显临床价值的新药”有39个,2017年按此理由获批的也有33个,由此可见“具有明显临床价值的新药”是优先审评产品中最多获批的理由。“同步申报”在2018年获批了14个产品。
“专利到期”是指19号文优先审评审批范围(一)中第4种情形,即“专利到期前3年的临床试验申请和专利到期前1年的药品生产申请”。目前来看,通过专利到期获得优先审评的产品并不多,更多仿制药以“同步申报”“首仿”“按与原研药质量和疗效一致的标准完善后重新申报”获得优先审评并得以上市。“罕见病”直到2018年才获批3个。
焦点5:
一致性评价申报达最高峰,未来走势?
从2016年开始的政策铺垫,终于在2018年开始发力。2018年,一致性评价无论申报数还是获批数,都是近年的最高峰。
2016年CDE升级化学药BE试验备案信息平台为化学仿制药生物等效性与临床试验备案平台,增加了仿制药一致性评价试验备案平台。BE备案平台开通后,2016年新申报化学仿制药BE备案品种41个,仿制药一致性评价BE备案品种16个。
2017年9月CDE实现仿制药一致性评价的集中受理,仿制药一致性评价申请平均审评审批用时约为70个工作日,仅为法定时限的一半。2017年一致性评价注册申请71件。
2018年,正式发布了8批参比制剂目录(涉及221个品规),对参比制剂发布情况及时整理,并发布了《289目录品种参比制剂基本情况表》。
2018年,化学药生物等效性试验备案平台已收集274条信息,仿制药一致性评价生物等效性试验备案平台已收集674条信息。一致性评价无论是申报还是获批,2018年是近年的最高峰。仿制药一致性评价临床有效性试验备案平台已收集2条信息,这提示,新三类的一致性评价还是要做临床有效性试验。
口服固体制剂方面,2018年受理一致性评价申请440件(涉及155个品种),其中289基药品种申请267件(涉及81个品种);通过口服固体制剂一致性评价申请111件(涉及57个品种),其中289基药品种申请63件(涉及36个品种)。
另一方面,业界关注的“4+7”对一致性评价申报的影响,仍待观察。
小结
从审评注册申请和获批情况来看,国内企业的注册申报逐步向新药方向转型。特别是在优先审评等政策支持下,新药获批上市的速度越来越快,肿瘤和心血管依然是新药研发的热门领域。
审评速度是企业最关心的事,积压的处理更是企业重点关注的。据悉,2019年由于各种原因审评速度在下降,那么2019年能否进一步将积压量降至2000以下呢?
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






