FDA临床试验要求趋松?
发布时间:2019-09-16 13:56:53作者:Zachary Brenna来源:医药经济报
2018年美国近半新药基于单一试验获批
FDA临床试验要求趋松?
早在20世纪70年代和80年代,美国FDA就明确表示,必须至少有两项设计科学、有对照组的临床研究才能证明一种新药的有效性,在非常罕见的情况下才能采用一项研究的数据支持有效性。
1997年,美国通过了《食品药品监督管理局现代化法案》,国会明确指出,FDA可考虑通过来自一项充分且对照良好的临床研究和确凿证据的数据批准新药。
A
上市后须完成药物再评价
在1998年发布的指导意见中,FDA提出,依靠一项研究进行审评一般只限于以下情况:一项试验就已证明对预防死亡、不可逆的损伤或具有潜在严重后果的疾病具有临床意义,而且进行第二项研究来证明第一项研究的结论在伦理上通不过(如新药的疗效远远超过老药,再让受试者接受老药对照治疗是不符合伦理的),而且实际操作上不可行(如罕见病)。“是否可以依赖于一项充分且对照合理的单一研究归根到底是一个判断力问题。基于两项有说服力的研究得出的结论总是比基于一项有相对有说服力的研究得出的结论更可靠。”该指导意见写道。
哈佛医学院医学教授Aaron Kesselheim表示,从历史上看,FDA的指导意见表明其倾向于进行两项充分且对照合理的试验,因为任何一项试验都可能受到未预料到或未被发现的系统偏差的影响。在某些情况下,新药的临床需要很迫切,或者药物的疗效足够强大,在这种情况下一项试验应足以获得FDA的初步批准。
“但是对单项试验的依赖,特别是当该试验为单臂、非盲或采用未经验证的替代指标作为研究终点时,会使患者增加对药物可能无预期那样有效的风险(或存在超过其获益的安全问题)。要明确告知患者他们使用的新药是在单一关键试验的基础上获批上市的,而且必须在上市后更密切地跟踪这些药物,以便在未来正式重新评估它们的利益和风险。但研究表明,对这些新药上市后的再评估要求往往没有全面完成或及时完成。”Kesselheim指出。
B
单一试验获批抗癌药居多
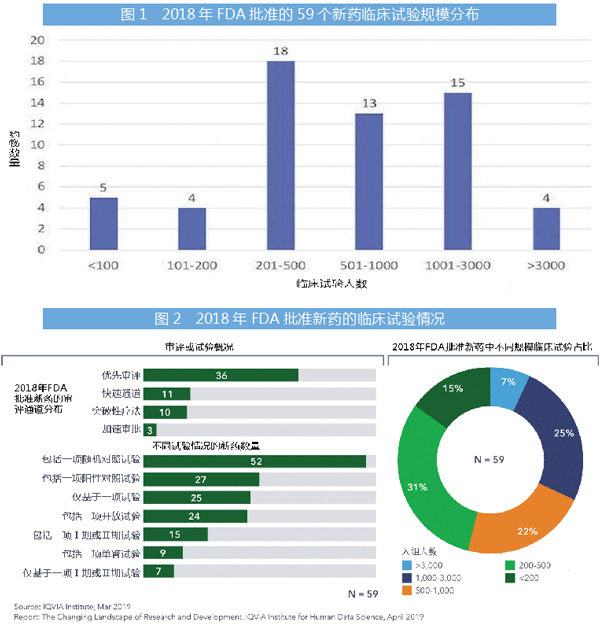
根据2014年《JAMA》杂志发表的研究,2005-2012年,FDA批准了188种新药,用于206种适应症,其中74种适应症(36.8%)是在一项关键试验的基础上获得上市批准。
最近,IQVIA发布了一份报告,其发现在2018年批准的59个新药中,有25个(占比42%)是在一项试验的基础上获得批准。其中,1/8是基于Ⅰ期临床研究或Ⅱ期临床研究,并没有进行Ⅲ期临床研究。与前几年一样,仅依靠一项试验获批的大部分新药是孤儿药和抗癌药。
例如,阿斯利康(AstraZeneca)的孤儿药Lumoxiti(moxetumomabpasudotoxtdfk)在2018年9月获批上市,主要是基于一项对不到100名罕见、进展缓慢的血癌患者的试验。在美国进行了纳入94例患者的一项试验后,Stemline Therapeutics公司也于2018年12月获得了Elzonris(Tagraxofusperzx)用于治疗罕见、进展迅速的骨髓和血癌的上市批准。
与此同时,其它抗癌药都是经过更大规模的单项试验后才获得批准。
例如,辉瑞(Pfizer)2018年9月获批的Vizimpro(dacomitinib),其临床试验纳入了452例晚期非小细胞肺癌亚洲病人;2018年6月获批的Array生物制药公司的Braftovi(encorafenib),其临床研究一共纳入了383例BRAF V600突变阳性黑色素瘤病人,而且都是不能进行外科手术或晚期的病人。试验地点包括欧洲、北美等地的162家医院;Advanced Accelerator公司的Lutathera(177 lutetiumdotate)是基于一个特定类型的罕见肿瘤的一项临床研究数据批准的。该研究有纳入了比利时、法国、德国、意大利、葡萄牙、西班牙、英国和美国41家医院的229患者。
不过,2018年基于一项临床试验结果获批的新药并非都是抗癌药。例如,Achaogen公司的Zemdri(plazomicin)是获批用于治疗复杂尿路感染的新药,其在欧洲、美国和墨西哥的研究纳入了604个患者;在亚洲、欧洲、以色列、拉丁美洲、南非和美国的86家医院对774名社区获得细菌性肺炎患者进行的单项试验结果的基础上,Paratek制药的抗菌药物Nuzyra(omadacycline)在2018年10月获得了上市批准。
2018年近半新药仅靠单一试验就获得批准,但Kesselheim并不认为这意味着新药上市已形成基于一项关键性试验即可的趋势,他也无法确定42%这一比例是表明该比例正在攀升,还是只是正常的逐年波动。
IQVIA报告还指出,与前几年相比,2018年的关键试验采用随机对照试验的数量略有上升,2018年的阳性对照组试验比前几年更常见。
编译/廖联明
来源/RAPS
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






