热议医械创新与规制
发布时间:2019-07-17 15:57:09作者:胡善联(复旦大学公共卫生学院教授)来源:医药经济报
医疗器械的创新和规制是2019年国际药物经济学和研究结果大会的重要议题之一。在此次医疗器械的创新和规制讨论中,与会专家主要希望解决以下几个问题:一是医疗器械市场的规制不断变化,不同国家的哪些变化相同、哪些变化不同;二是HTA机构对医疗器械的要求与监管部门的要求有哪些区别;三是医疗器械的创新对提高疗效和安全性方面有哪些影响;四是立法规制对整个医疗器械产业会产生怎样的影响;五是关于医用器材的HTA研究与药品的研究有哪些异同点。
市场准入:医械监管对标美国
医疗器械的市场准入在不断变化。不同的国家在医疗器械规制上有何异同,对这些国家的医疗器械工业会带来怎样的影响,都需要认真研究。对HTA机构的要求,也随不同国家规制要求的不同而有所不同,包括对创新医疗器械的效果和安全性要求。在美国,医疗器械主要由FDA管理,且与该国医保和商保的发展密切相关。从全球范围来看,不同国家和地区的医疗器械监管政策也与美国FDA的做法有一定相关性,如欧盟地区和中欧的一些国家。
美国FDA对医疗器械的管理是通过器械与放射健康中心(CDRH)进行的,该中心监督医疗器械的生产、包装、经销商是否遵循相关法律而进行经营活动。医疗器械范围很广,FDA将医疗器械分为Ⅰ、Ⅱ、Ⅲ类,类别越高,监督越多。美国FDA医疗器械上市前许可510(k) 文件是医疗器械厂商向FDA递交的上市前申请文件,目的是证明申请上市的器械与不受上市前批准(PMA) 影响的合法上市器械同样安全有效,即为等价器械(substantially equivalent)。申请者必须将申请上市的器械与现在美国市场上一种或多种相似器械对比,得出并且支持等价器械的结论。如果FDA认为这项技术与原有技术安全性和效果方面相同,则认为是同类的。反之,则属于Ⅲ类医疗器械,需要PMA证实。除非将新的技术定为是Ⅰ类或Ⅱ类。
合法上市器械是指在1976年前合法上市的器械(preamendment device),或者从Ⅲ类器械中分入Ⅱ或Ⅰ类的器械,或者通过510(k)程序发现与这样的器械等价的器械,或者通过自动的Ⅲ类器械定义的评价建立的器械,与之等价的器械被称为“predicate device(s)”。美国的大部分医疗器械是通过510(k)文件证实的,如2017年有3287件医疗器械是通过510(k)文件证实,而通过PMA上市前批准的只有59件(1.76%)。医疗保险能够对医疗器械补偿和报销是基于循证为基础的评价。在美国,药品100%需要FDA批准,但在医疗器械方面,经过PMA证明的90%可以得到报销,而通过510(k)证明的只有65%左右可以得到报销。但前者是60%的费用可以报销,后者只有79%的费用被报销。
过去,医疗仪器主要由FDA审批并发放批准文号, 现在美国联邦医疗保险和商业保险公司也积极介入。在欧盟,也需要有新的市场准入证明文件以及需要有HTA的评估。
美国医疗器械的规制和补偿是分开的,对循证的要求也在不断增加。在510(k)文件提交FDA时,与支付方的要求一致。FDA批准的时间不等于上市时间。在按证据为基础的补偿情况下,快速提交的510 (k)文件不一定能满足市场的要求。
HTA:
建立以价值为基础的执行计划
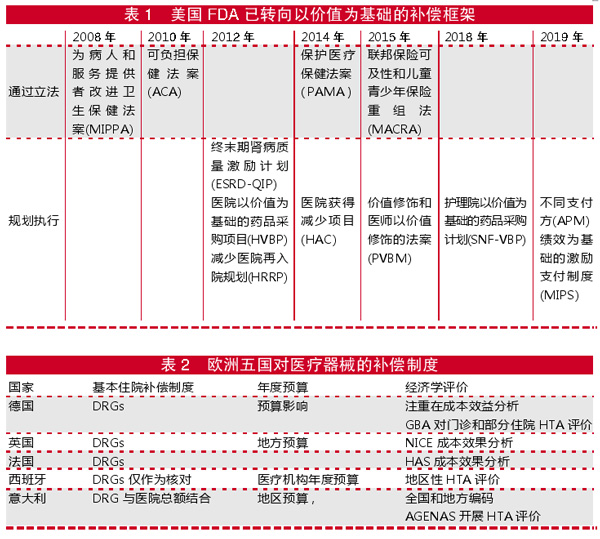
医保支付者对医疗器械HTA的要求在于:一是希望能够证明其价值和成本效果。通过成本效果、成本效益和预算影响分析得到证实;二是物有所值。如果不能证实物有所值,美国商业保险机构或欧盟一些国家完全有权力不予报销;三是要明确定义目标的患者人群。因为越是大量患者使用,越容易造成医疗技术的乱用,造成医保基金的浪费;四是需要有当地的临床证据资料,如日本和中国;五是价值判断主要是依据临床效果和经济性。近10年来,美国FDA已转向以价值为基础的补偿框架,不同时期出台不同的法案,通过立法提高医疗保险的覆盖率和降低医疗保健的负担,同时也创造了一些以价值为基础的执行计划。
美国健保服务中心(CMS) 确定了29个住院病种和3个门诊病种实行捆绑式支付,也就是说,由医疗保险的支付方根据该医院前四年的有关费用的平均值再减少1%~3%的费用作为定额支付给医院,包括住院或门诊期间和以后的90天内的所有费用,以利于提高服务质量,节省费用。
在美国,FDA与CMS两个组织平行评审,帮助医疗器械公司早日利用真实世界的数据,商业的支付方提供资金促进创新技术的临床试验。对医疗器械实行管理式准入合同。另外还有一个NEST合作中心项目是由FDA资助、MDIC组织推行,旨在收集真实世界的数据,满足不同部门组织的需要。
在欧盟,在医疗器械方面有一个3年过渡期,在卫生经济和结果研究方面注重临床评价,其次是注意警戒和上市后的监测,在附加的临床证据收集方面,强调临床评价和风险,同时文献评阅和临床报告,包括收集上市后的资料和监测。上市后的临床随访(PMCF),当发生反应时由原来30天内报告缩短到15天,要求对所有的医疗器械进行新的电子监测和周期性的安全性报告。
欧盟各国HTA的发展也是不平衡的,各国使用的HTA研究方法也不同,研究的时间点也不一样,接受的申报材料也有所不同。使用的HTA方法反映了当地市场准入的模型、不同卫生服务提供和筹资的方式,从而导致各国之间的研究碎片化,合作研究也有限。
2018年1月欧盟建议开展联合HTA临床评价研究。运用共同的HTA 工具和评价方法来决定医疗器械的定价和补偿问题。其认为医疗器械应集中在以下四个方面进行研究:(1)联合临床评价:集中在创新技术方面,且是对患者健康影响较大的技术;(2)联合科学咨询:创新者可以到FDA的建议和帮助。(3)能早期确定新出现的技术;(4)促进在其它领域继续自愿合作。至今,欧盟已有81个国家级、地区级和非营利性质的合作组织,从事于HTA方面的研究。
真实世界研究:挑战与机遇并存
之所以说医疗器械的真实世界研究很重要,是因为医疗器械的临床试验充满着挑战,对患者或医师不可能采用盲法研究。外科医生的手术或技术有一个学习过程,对结果存在很强的混杂因素。医院的使用过程也会影响到医疗器械的结果。医疗器械的发展很快,每3~5年就是一个创新周期,治疗后的长期随访也相当困难,具有高度的失访率。研究招募病人也比较困难,往往病人数量少。
真实世界数据的来源有医疗器械公司的数据库、医院数据库、医院的电子病历医保病人报销的数据库和病例登记材料。此外,还可进行病人调查、医生调查、病人偏好调查,以及依据穿戴式的设备记录、社会舆论以及医疗器械自身的数据。总之,医疗器械研究存在着太多的挑战。如缺乏长期的、综合的、纵向的资料,有限的外科、专家和技术的资料,缺乏患者报告和发生的资料、有限的和有质量的临床数据,缺乏器械标识的标准。
不过,医疗器械的研究也有很多机遇,如果可以改进分析的方法,控制混杂因素、模拟临床试验,应用新的真实世界研究指南,则有利于减少不确定性,保证医疗器械的安全性和疗效,提供效果的证据。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






