药企加码研发 1类新药NDA同期增150%
发布时间:2019-07-15 11:37:51作者:本报记者 胡睿来源:医药经济报
近年,国家药监部门对药品审评流程改革加大力度,配套流程与规则不断优化,药品申请批件审评进程提速,药品审评部门完成的化药、生物药审评数量都大幅度增加。
近日,国家药监局发布的《2018年药品审评报告》显示,2018年,药审中心受理1类创新药注册申请共264个品种(涉及533件受理号,化药的品种数以活性成分统计,中药和生物制品的品种数均以药品通用名称统计,下同),较2017年增长21%。其中,受理1类创新药的新药临床试验(IND)申请239个品种,较2017年增长15%;受理1类创新药的新药上市申请(NDA)25个品种,较2017年增长150%。
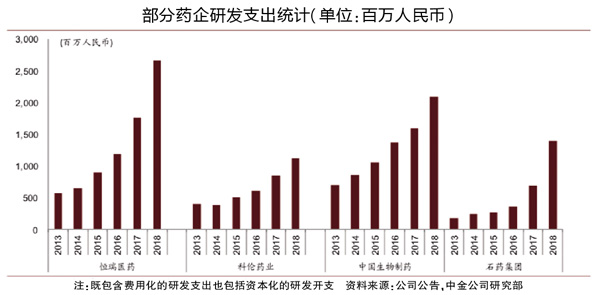
《医药经济报》记者在采访中了解到,随着政策端对创新药的鼓励,药企也在加大创新药研发投入,近年来药企研发投入和在研创新药数量都有较大幅度提升。中金公司研究部的数据显示,2013-2018年,恒瑞医药、科伦药业、中国生物、石药集团的研发投入增速较快,从以百万计上升为以千万计。
医保纳新速度提升
1999年我国制订了基本医疗保险药品目录制度,原则上每两年调整一次;2000年我国首版国家基本医疗保险药品目录公布;2004年我国第二版国家基本医疗保险药品目录公布,与上一版相隔了4年;2009年第三版国家基本医疗保险药品发布,与上一版相隔了5年。在两次医保目录调整期间,即使新药上市,也无法及时纳入国家医保目录。
从2016年开始,国家医保目录调整速度加快,2016年国家药品价格谈判将替诺福韦、埃克替尼、吉非替尼三种创新药纳入国家医保。2017年2月新版国家医保目录公布,同年7月将36种新药通过谈判方式纳入国家医保目录。2018年,17种抗癌药通过谈判方式纳入国家医保目录。
2019年,医保局又将进行新一轮的医保目录调整。随着医保目录调整频率的加快,新药纳入医保的速度正在提升,而在纳入医保后,新药往往能够实现较大程度的销售放量。
中国医药创新促进会会长宋瑞霖接受媒体采访时曾指出,医保的目的不是为省钱,而是解决临床需求,患者的利益才是医保追求的终极目标。但省钱却是患者的核心利益之一,也是医保的职责所属。所以,医保一方面要大力支持创新药,在专利期间,尽可能让其纳入医保目录,让老百姓尽早用上;另一方面,当仿制药(疗效和副作用应与原研药一样)出来之后,应更多关注仿制药,以平抑价格。创新药厂家此时已得到市场回报,有动力进行下一轮创新,形成一个创新的良性循环。所以创新药与仿制药有一个对立统一的关系。
宋瑞霖认为,医保作为支付方的代表,对创新的态度,是决定创新药生存环境的一个重要方面。任何产品最后都是在市场中去检验,如果市场支持这个产品,国家政策应引导释放市场的需求。当创新药有了市场需求,它就能展现出应有的价值,最终让患者得到实惠。而对于产业来说,创新药得到了良好的回报,则更愿意去创新,加入到研发创新药的队伍中来。医保政策这个环节虽然在最后,但对前期的研发创新起到了决定性推动作用。
多渠道进优先审评
除了创新药快速纳入医保的政策倾斜以外,药品审评审批改革也大大促进了创新药的快速入市。
42号文件是近5年来中国药改最重磅的文件之一,落实了上市许可持有人的法律责任。目前,上市许可持有人制度试点已经结束,之所以没有全面推开,主要原因在于《药品管理法》没有正式出台,因为上市许可持有人制度的全面实施需要《药品管理法》中的一些规定作为支撑。
目前,已经有消息透露,《药品管理法》将在今年年底正式出台。
同时,42号文曾提出要进一步优化审评审批程序,明确两个附带条件批准,一是罕见病用药,二是临床急需药。去年,治疗复发或转移性乳腺癌的新药马来酸吡咯替尼片上市申请获有条件批准。该药属于我国自主研发的创新药,通过优先审评审批程序获准上市。艾博韦泰长效注射剂获国家药品监督管理局批准上市,这是药审中心满足临床急需、对艾滋病治疗药物进行优先审评政策实施后取得的成果之一。
另外,药审审评流程也进行了优化。药审相关人员介绍,“我国药物临床试验审评审批制度已经正式由审批制变为到期默认制。在我国申报药物临床试验的,自申请受理并缴费之日起60日内,申请人未收到国家药品监督管理局药品审评中心否定或质疑意见的,可按照提交的方案开展药物临床试验。”
他也指出,新药首次药物临床试验申请之前,药审中心会召开沟通交流会进行详细说明。沟通交流会议资料应包括临床试验方案或草案、对已有的药学和非临床研究数据及其他研究数据的完整总结资料。申请人应自行评估现有的研究是否符合申报拟实施临床试验的基本条件,并明确拟与药审中心讨论的问题。在申请人按沟通交流相关要求按时提交完整的沟通交流会议资料后,药审中心对沟通交流会议资料进行初步审评,在沟通交流会议召开至少2日前,将初步审评意见和对申请人所提出问题的解答意见告知申请人。
另外,近期发布的《中华人民共和国疫苗管理法》对新型疫苗研发也给出了明确的鼓励措施。
一是明确规定国家支持疫苗基础研究和应用研究,促进疫苗研制和创新,将预防、控制重大疾病的疫苗研制、生产和储备都纳入了国家战略。
二是国家制定疫苗行业发展规划和产业政策,支持疫苗产业发展和结构优化,鼓励疫苗生产规模化、集约化,不断提升疫苗生产工艺和质量水平。
三是国家根据疾病流行情况、人群免疫状况等因素,制定相关的研制规划,安排必要的资金,支持像多联多价疫苗等新型疫苗的研制,组织疫苗上市许可持有人、科研单位、医疗机构联合攻关,研制疾病预防控制急需的疫苗。
四是鼓励疫苗上市许可持有人加大研制和创新资金的投入,优化生产工艺,提升质量控制水平,推动疫苗的技术进步。
五是对于创新的疫苗实行优先审评审批。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






