登记原料药关联审评率达7.8%
发布时间:2019-07-11 16:33:05作者:本报记者 刘卉来源:医药经济报
重庆重金奖补原辅料登记、海外注册
登记原料药关联审评率达7.8%
国家政策支持以及地方奖补政策的资金配套,给予国内原辅料企业可持续的发展空间。近日,重庆市政府网发布了重庆市人民政府办公厅关于印发《重庆市加快生物医药产业发展若干政策》的通知,对于原辅料登记和标准提高给予一定奖励。
百万政策福利
重庆取得登记号的新原料药,所关联制剂首次获得上市批准或首次关联已上市制剂品种通过关联审评,给予100万元的一次性奖励
记者梳理重庆文件发现,一是原辅料登记奖励。对取得登记号的新原料药,所关联制剂首次获得上市批准或首次关联已上市制剂品种通过关联审评,给予原料药产品登记人100万元的一次性奖励;对取得登记号的新辅料,所关联制剂首次获得上市批准或首次关联已上市制剂品种通过关联审评,给予辅料产品登记人50万元的一次性奖励。
二是支持产品质量标准再提升。对于进一步提升产品质量,达到美国、欧盟和日本等主流市场认证标准并在当地首次完成产品注册的产品上市许可持有人给予一次性奖励。其中,关联美国、欧盟和日本等主流市场上市的制剂品种的原料药每个奖励50万元、辅料每个奖励10万元。
该政策已于5月中旬实施,有效期至2022年12月31日。
“目前,审评费用是免费的,但产品的开发和质量标准的提升需要一定的资金投入。从文件看,重庆的奖励力度还是很大的。如果推进得好,其他地区特别是一些原辅料大省是否会参照重庆奖励政策值得期待。”中国药用辅料发展联盟(CPEC)秘书长、国际药物制剂网(PHEXCOM)CEO施拥骏对《医药经济报》记者表示,这也体现了重庆市对加快生物医药产业发展的重视。
常用品已登记
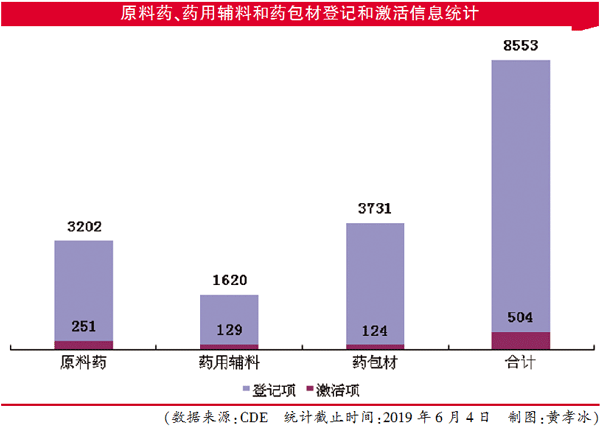
目前,药用辅料登记数据显示已有1620个登记号。与去年同期的辅料登记仅411个相比,大约增加了4倍
此前,国家药品监督管理局官网发布《关于进一步完善药品关联审评审批和监管工作有关事宜的公告(征求意见稿)》。根据要求,原辅包与药品的关联审评审批可由原辅包登记人在登记平台上登记,药品制剂申请人提交注册申请时与平台登记资料进行关联;也可在药品制剂注册申请时,由药品制剂申请人一并提供原辅包研究资料;原则上对原辅包不再单独审评审批,但仿制国内已上市的原料药除外。
业内指出,新制度将过去孤立、分散的原辅包与其关联的制剂统一在一个平台上管理,方便制剂申请人选择合适的原料药、药用辅料和药包材,加快制剂研发和注册申报速度。
CDE网站上的“原料药、药用辅料和药包材登记信息公示”平台开放至今,已有越来越多的企业产品登记提交相关资料。6月4日,《医药经济报》记者检索该平台发现,更新日期截至6月3日,药用辅料登记数据显示已有1620个登记号。而在去年同期记者查询时,辅料登记仅411个,大约增加了4倍。
在登记的辅料品种中,常用辅料品种淀粉,包括羧甲淀粉钠、可溶性淀粉、玉米淀粉等,已有103个登记号;明胶,涉及到胶囊用明胶、明胶空心胶囊等已有137个登记号,大部分为国产。截至5月31日更新,已登记的原料药数据显示已有3202个,包括富马酸替诺福韦二吡呋酯、盐酸利多卡因、地高辛、头孢地尼、恩格列净等。
“常用的原辅料品种大多已登记。”施拥骏表示,“还未登记的产品和企业进度缓慢的原因预计有很多,比如资料准备需要时间。其次,一些企业可能不做原料药、药用辅料,转型做食品了。还有一些小的原辅料品种,国内没有生产,国外品种暂时还未在国内进行登记。”
关联激活不足
自主登记的原料药、辅料和药包材资料件达到8553件,已被激活的共有504件
原料药、辅料、药包材与制剂关联审评已实施一短时间,从总体情况看,截至6月4日,自主登记的原料药、辅料和药包材资料件达到8553件,已被激活的共有504件。已激活的原料药、药用辅料或药包材,即已完成了与制剂的关联审评。其中,比伐芦定、替格瑞洛、阿哌沙班、硼替佐米等251项原料药;微晶纤维素、聚乙二醇6000、硬脂酸镁等129个辅料显示已被激活。
公众号“药渡”在前不久统计了企业完成登记情况。数据显示,截至5月10日,原料药关联最多的是埃索美拉唑钠(9个)、盐酸莫西沙星(8个)和帕瑞昔布钠(7个)。从企业贡献来看,已完成与制剂关联审批的企业中,完成数量最多的前三家企业分别是齐鲁制药有限公司(9个)、扬子江药业集团江苏海慈生物药业有限公司(8个)和连云港润众制药有限公司(7个)。
已有药用辅料关联最多的是微晶纤维素(4个)、蛋黄卵磷脂(2个)、交联羧甲基纤维素钠(2个)、羧甲淀粉钠(2个)和硬脂酸镁(2个)。而按照企业激活的药用辅料数目来看,在已激活的药用辅料中,大部分企业只完成了1个药用辅料的激活(占比94%),斗山公司、GATTEFOSSE SAS和BASF SE分别完成了2个,而法国罗盖特公司和瑞登梅尔(上海)纤维贸易有限公司分别完成了3个。
“激活需要时间。”采访中,前述专家表示,现在原料药企和制剂企业已经是命运共同体。“目前,原辅料、制剂企业存在的困境是,国内没有生产、国外企业又不愿关联的小众辅料要加快引进。”施拥骏建议。
制剂合作增加
如何将原辅料、包材纳入药品生产体系、质量管理体系、创新研发体系,如何从产业角度加强对原辅包的掌控力度,将成为制剂企业长远发展、立足市场的关键
原料药登记数据库现共有3202条记录,但已激活并批准完成与上市制剂联合审评审批的有251条,占比为7.8%,大部分原料药处于未与制剂完成关联的状态。
这或是受到药品审评所需时限和政策过渡的影响。《医药经济报》此前有业内专家撰文分析指出,在正式文件发布之前,多数药企不会贸然提前布局,一是政策当时尚未明确,大部分原料药企业没有专门的下游制剂生产商,政策公布后再去寻求制剂厂商合作,既费时又费力。
二是许多制药企业原料药的再注册批件尚未到有效期,按照规定还是具有法律效应的,这类企业也暂不急于找制剂厂商进行合作。
当然,也有制剂企业不愿轻易改变原料药来源的考虑在内,毕竟重大变更需要重新进行生产工艺验证、现场和抽样检查,甚至加速长期稳定性实验,这一系列工作会让制剂停产至少半年时间,这显然是制剂厂商所无法接受的,除非能够带来远超投入的收益。
当前完成与制剂关联审评的原料药数量仍较少或与上述原因有关。不过,专家预计,随着未来政策不断实施推进,以及原辅料和药包材“政策福利”逐渐到期,加上一致性评价工作和MAH制度对高质量药用原辅料和药包材需求不断提高,将促使更多的原料药、药用辅料和药包材企业积极寻求与药用制剂厂商的合作,完成与制剂关联审评的原料药登记数量也将持续上升。
而从制剂企业的角度来看,业内有分析称,关联审评将制剂企业与原辅包企业更加紧密地关联到一起,未来制剂企业如何将原辅料、包材纳入药品生产体系、质量管理体系、创新研发体系,如何从产业角度加强对原辅包的掌控力度,将成为一部分制剂企业长远发展、立足市场的关键。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






