2019全球在研新药增势延续 释放积极信号
发布时间:2019-07-09 12:33:33作者:本报特约撰稿 闫庆松来源:医药经济报
近年来,虽然化学合成小分子药研发愈发困难,全球制药行业尚未走出低谷,但全球在研新药数量继续保持增长,新的药物作用靶标以及新的治疗方式不断被发现和应用。2019年,全球新药研发也呈现出诸多新特点。
Pharmaprojects数据库收录的在研药品信息,特指目前处于在研状态的药品研发项目,包括处于临床前研究阶段的项目、处于不同临床研究阶段的项目、处于注册审评阶段的项目,以及增加新适应症开发的已上市药物。本文对2019年全球在研新药的总体规模和分阶段规模变化进行分析。
总体规模
增速触底回升
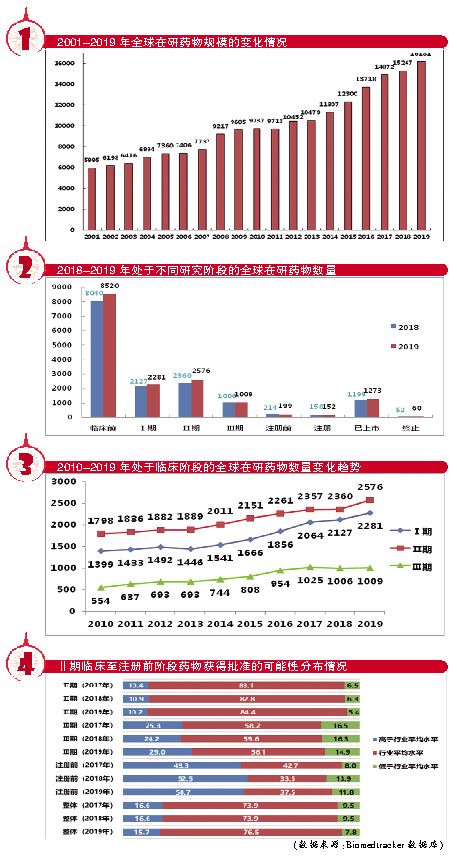
截至2019年1月,全球在研新药数量为16181个,与2018年的15267个相比,同比增幅为5.99%。
从2001-2019年数据来看,全球在研新药数量保持持续增长态势,新药数量记录不断被刷新到新的高度。
然而,需要特别注意的是,2014-2017年全球在研新药数量同比增幅均在8.0%以上,而2018年该增幅仅为2.7%,降幅尤为明显。庆幸的是,2019年全球在研新药数量同比增幅已回升至6%左右。
选取过去三年数据进一步分析,2017年、2018年和2019年全球在研新药数量增幅分别为8.41%、2.66%和5.99%,平均增幅为5.69%。虽然2019年增幅高于三年平均值,但全球在研新药数量增速能否尽快回升至8%以上,仍存在不确定性。
从在研药物数量的变化情况来看,2019年全球在研药物数量增加914个,较2018年的增加数量(395个)相比出现了较为明显的增长,但与2016年和2017年的增加数量(分别为1418和1154个)相比尚有一定的差距。在研药物数量的增加,在一定程度上反映了药品研发市场的热度,但更多候选产品的出现并不意味着更多产品可以跨越药品研发过程中存在的种种障碍,仍要看最终是否能通过注册审评成功上市销售。
生物药是新增长点
近年来,化学小分子药物开发难度逐年增加,一些在研项目出现项目终止情况,净增长数量也出现了下滑。但生物药却呈现出蓬勃发展的势头,在获批数量和市场销售额占比等多个指标上,均呈现出愈加明显的竞争优势。
以FDA批准的新药数量为例。2017年FDA共批准新药46个,包括34个新分子实体药物(NMEs)(占74%)和12个新生物制品(占26%);2018年FDA共批准新药59个,包括42个NMEs(占71%)和17个新生物制品(占29%),批准数量和通过率皆创近20年来新高。FDA批准新药数量的上一个高峰是在1996年,批准新药数量为53个。目前生物制品在FDA批准新药中占比已接近30%。
虽然整个制药行业增速仍未完全走出低谷,但全球在研药物数量继续保持整体增长是个积极信号。生物药的快速崛起,已成为制药行业新的增长点。
分阶段解析
从制药研发流程来看,新药研发可分为三个阶段:首先,通过临床前研究发现并确认候选药物;其次,通过临床研究验证候选药物的有效性和安全性;最后,顺利通过注册及上市环节,最终实现候选药物的临床价值。
通过对比2019年和2018年处于不同研发阶段的在研药物规模可以发现,所有阶段的在研药物数量基本维持不变或仅有小幅变动。
各阶段增幅不一
其中,处于临床前研究阶段的候选药物数量变化相对明显,2019年处于该阶段的药物数量为8520个,较2018年数量(8040个)增加480个,同比增幅为5.97%,与全球在研药物的平均增速相当,但该增速与2018年7.3%的增速相比仍有所下降。据统计,2019年新进入临床前研究阶段的药物数量为4001个,与2018年数据(3807个)相比有所增加,该数据较2017年创纪录的数据(4005个)仅有微小差别。在这些临床前研究项目中,许多项目来自小型创业公司。
处于临床研究阶段(包括Ⅰ期、Ⅱ期和Ⅲ期临床阶段)和上市阶段的在研药物数量呈现增长态势,在研药物数量分别为5866和1273个,同比增幅分别为6.8%和6.2%。处于注册阶段的在研药物数量仅有小幅增长,在研药物数量为152个,增幅仅为1.33%。处于注册前阶段的在研药物数量则呈现出下滑趋势,在研药物数量为199,同比降幅为7.0%。
处于上市阶段的在研药物,一般是指开发新治疗领域或增加新适应症的已上市药物,如果没有进一步研发进展,则被视为完全上市,并从该类别中移出不再进行统计。2018年实现首次上市的在研药物数量为108个,该数据与2017年类似,这些药物的状态已变更为“完全上市”,被认为已基本完成,因此会被移出统计范畴。
Ⅱ期临床失败增多需重视
对处于临床研究阶段的在研药物数据进一步分析后发现,2019年处于Ⅰ期、Ⅱ期和Ⅲ期临床研究阶段的药物数量分别为2281个、2576个和1009个,增幅分别为7.2%、9.2%和0.3%。其中,处于临床Ⅰ期研究阶段的药物数量增幅较为明显,而2018年该类药物增幅仅为3.0%;处于临床Ⅱ期阶段的药物数量增幅更为显著,而2018年该类药物增幅仅为0.1%;处于临床Ⅲ期的药物数量基本无变化。
从现有数据来看,虽然临床Ⅱ期的药物数量出现了大幅增长,但这种增长优势却并未在临床Ⅲ期继续延续。简单来说,就是更多的在研药物在临床Ⅱ期遭遇了失败,以至于最终进入临床Ⅲ期的药物数量十分有限。同时,从临床Ⅲ期进入“待审批”或“待上市”状态的药物数量也出现了下滑,2019年该类药物数量下降了3.6%,较2018年1.9%的降幅呈现出进一步的下行态势。不难看出,处于研发后期的品种仍存在流失率较高的情况,应引起注意。
对2010-2019年临床数据的进一步分析后还发现,处于Ⅰ期临床研究阶段的药物数量表现出持续增长的势头,处于Ⅱ期和Ⅲ期临床研究阶段的药物数量增长趋势和增幅基本一致,2016-2018年其增幅均有放缓的趋势。然而,2019年这两类药物增幅的一致性却被打破了。在研药物从临床Ⅱ期进入Ⅲ期存在品种转化率过低的现象,且这种情况正在进一步恶化,越来越多的药物在Ⅱ期临床研究过程中被终止。
如何合理布局研发链
对于在研药物市场的评估,在研药物数量是一方面,质量同样重要。由于药品研发成本较高,因此开发更多的新品种,需要通过上市销售一些新产品以提供持续的研发资金支持,否则药品研发工作将不可持续。
在资源有限的情况下,需要结合不同阶段新药获批的可能性,以及现有品种的成熟度情况,对不同阶段的品种分布和资源配置情况进行调整,以实现整体研发工作的合理布局。
Biomedtracker数据库会对项目的临床和注册进度进行分析,以评估一种药物获得FDA批准的可能性,并确定一种药物是否较其他同类药物更易获得批准。从统计数据来看,2019年临床Ⅱ期药物获批可能性高于行业平均水平的药物比例约为10.2%,较2018年数据(10.9%)略有下降,对于大多数处于该阶段的药物而言,药物获批的可能性较低;临床Ⅲ期药物则相反,2019年获批可能性高于行业平均水平的药物比例为29.0%,较2018年数据(24.2%)有小幅增长;“注册前”药物获批可能性高于行业平均水平的药物比例约为50.7%,较2018年数据(52.5%)有所下降。从临床研究阶段的整体数据来看,2019年占比15.7%的在研药物获批可能性会高于行业平均水平,该比例与2018年数据(16.6%)相比有所下降。
结语<<<
从美国的新药获批数据以及近年来全球在研产品管线的持续扩张情况来看,行业整体情况有所好转。但是,需要注意的是,今年处于Ⅲ期临床的药物仍相对较少,如何提升Ⅱ期临床研究项目的成果转化率,应是多数大型制药公司需要考虑的一个问题。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






