不靠“超级药”而靠“小而全” 诺华2024或登顶
发布时间:2019-05-23 18:01:14作者:李勇来源:医药经济报
市场调研机构Evaluate Pharma曾经发布报告预测,到2024年,就药物销售额计算,诺华将会在全球制药公司排行榜中登顶。不过,在2024年全球最畅销15大药品中,诺华不会有任何产品上榜。诺华依靠的不是“超级重磅炸弹”,而是依靠一批销售规模相对较小的药物来支撑自己的竞争实力。
CAR-T领域领先者
到2024年,诺华的自身免疫性药物Cosentyx(Secukinumab,苏金单抗)将成为该公司销售规模最大的产品(销售额预测为55亿美元),其次是心力衰竭药物Entresto (sacubitril/valsartan,沙库巴曲/缬沙坦钠,LCZ696),销售额将达到44.3亿美元。分析人士表示,届时诺华将拥有10个“重磅炸弹”,另有12个年销售额超过5亿美元的药物。
与此同时,在CAR-T这类下一代癌症治疗药物领域,诺华处于领先地位,其开发的Kymriah(tisagenlecleucel,CTL019)是全球首个获批的CAR-T药物。2018年4月,诺华以89亿美元的价格收购了基因药物开发商AveXis,获得了一个有潜力成为“重磅炸弹”的药物AVXS-101。诺华2018年有15个产品(或组合)销售额达到10亿美元以上。
新药项目
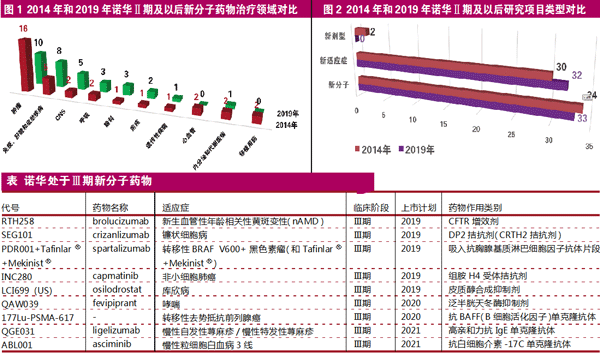
诺华关注的主要疾病领域包括:免疫肿瘤;中枢神经系统(CNS);心血管和代谢疾病;自身免疫、移植和炎症疾病;肌肉骨骼疾病;眼科;呼吸疾病;热带病。
新分子药物33个
2019年,诺华处于临床试验Ⅱ期及更晚期研究项目包括:新分子项目36项,涉及33个药物。以分子类型来看:小分子21个(占64%),抗体药9个(占27%),基因疗法2个(占6%),蛋白疗法1个(占3%);新适应症项目32项。同时还在开发LA-EP2006(培非司亭)生物类似药。整体来看,诺华除处于研发Ⅲ期32项、Ⅱ期30项外,还有向监管机构提交了3项新分子和3项新适应症上市申请。
以新分子药物数量(33个)的研究阶段来看:正在审评3个(占9%),Ⅲ期9个(占27%),Ⅱ期22个(占64%)。
与2014年比较
与诺华2014年公布的研发线相比,肿瘤、中枢神经系统、自身免疫、肝脏和炎症疾病仍旧是新分子药物最集中的领域。不过在抗心衰药物Entresto(沙库巴曲缬沙坦钠片,LCZ696)获得批准上市、RLX030(serelaxin)遭遇关键Ⅲ期临床失败之后,诺华已经没有处于研发晚期阶段的心血管药物。
在推进新分子药物上市方面,与2014年相比,诺华从2019年起每年(2019-2022年)提交上市申请药物数量分别为:2个(不包括已在审评3只)、3个、7个、4个,2014年起每年(2014-2017年)提交上市申请药物数量分别为:4个(不包括已在审评3个)、2个、2个、4个。
与2014年相比,诺华2019年公布的处于临床试验Ⅱ期以及更晚期项目并没有显著增加,2014年和2019年新分子药物数量分别为34个和33个,新适应症研究项目分别为30项和32项,新剂型分别为2个和0个。
在审评项目
诺华目前已经提交上市申请正在审评的项目,包括新分子药物3个和新适应症药物2个。
1.AVXS-101 (Zolgensma)
该药是诺华于2018年4月通过收购AveXis公司获得的基因疗法产品,主要用于脊髓性肌萎缩症(SMA)的治疗,已向美国FDA提交了生物制剂许可(BLA)申请,同样的申请也已向欧盟和日本的监管机构提交。预计到2019年中期,三家监管机构都将作出决定。AVXS-101如果获批上市,将成为第二款上市的治疗SMA的基因疗法(首款是Spinraza)。
2.LCI699(osilodrostat)
该药是一款醛固酮合酶抑制剂,适应症为库欣综合征。该药于2014年被欧洲药品管理局授予孤儿药资格,诺华目前已在欧盟提交上市申请,在美国处于Ⅲ期临床研究。Ⅱ期临床研究显示,osilodrostat可有效控制89%患者的皮质醇水平,并在后续31个月的扩展期间使患者持续获益。
3.BYL719(alpelisib)
该药是一款口服α亚型特异性PI3K抑制剂。它能够强力抑制PI3K信号通路,从而达到抑制肿瘤细胞增生的效果。Ⅲ期SOLAR-1试验中,该药达到了其主要终点,能够改善携带PIK3CA突变的激素受体阳性(HR+)/人表皮生长因子受体2阴性(HER2-)晚期乳腺癌患者的无进展生存期(PFS)。诺华已经在美国和欧盟分别提交该产品新药上市申请。
4.其他
此外,诺华在欧盟提交药物新适应症上市申请项目有:Lucentis(ranibizumab,雷珠单抗)治疗早产儿视网膜病变、糖尿病性视网膜病变。Promacta/Revolade(eltrombopag)治疗严重的再生障碍性贫血。
值得一提的是,诺华的Mayzent(siponimod)还在今年3月26日获得FDA批准上市,用于复发型多发性硬化症(MS)成人患者的治疗,包括活动性继发进展型多发性硬化症(SPMS)、复发缓解型多发性硬化症(RRMS)、临床孤立综合征(CIS)。Mayzent是过去15年来首个也是唯一一个专门批准用于活动性SPMS患者的治疗药物。
另外,诺华还有9个新分子药物处于临床Ⅲ期研究阶段,有望在未来3年陆续申请上市。
在审评项目
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。






