史上最复杂药物 基因治疗新药下一波
发布时间:2019-05-08 15:42:39作者:廖联明来源:医药经济报
史上最复杂药物 基因治疗新药下一波
基因疗法很可能是有史以来最复杂的药物类型。
基因疗法经历了漫长而曲折的道路。其概念的首次提出是在45年前,但早期基因疗法的临床研究遇到了严重的副作用,却又促进了相关的基础研究,从而寻找到更安全有效的基因转移载体。
基因治疗的应用始于上世纪90年代初,但临床试验结果总是反复,令人失望:有的没有临床疗效,有的产生意想不到的毒性,甚至导致患者死亡。上世纪90年代末和本世纪初,新载体的开发和对靶细胞的更好理解,引发了第二代临床试验潮。然而高基因转化率相关的严重毒性出现了,如插入性基因毒性以及与某些载体给药有关的免疫反应。
在最近的十年,基因治疗的基础科学研究进一步成熟,安全性的改进以及基因转化和传递效率的提高,最终促成了实质性的临床进展。
目前,一些基因和基因修饰细胞疗法已经被批准用于临床治疗,另外十几种疗法已经被美国和世界各地的监管机构认定为“突破性疗法”。还有不少成熟的临床试验正在酝酿在新的治疗领域上市新的基因治疗产品。
但仍然存在许多挑战,包括提高基因转移或编辑效率,解决对载体重复体内给药的免疫反应,以及昂贵的治疗费上如何达成社会共识等。
方向1:体内基因传递
体内靶向器官基因传递非常有吸引力。然而,体内方法依赖于组织特异性靶向或局部传递和/或靶细胞特异性基因表达,因而存在很大的挑战——意外的生殖细胞修饰是令人担忧的,对载体成分的免疫反应也可能发生。其中,有一些挑战已经被克服,在肝脏或眼睛视网膜色素上皮的传递基因方面已经取得了令人鼓舞的临床结果。
肝脏
临床研究表明,注射到肝脏的腺相关病毒(AAV)载体可改善血友病B和血友病A。治疗患者转基因可表达数年,导致循环因子Ⅸ水平达到正常的2%~7%,从而减少重组因子Ⅸ的输注。采用编码因子Ⅸpadua基因(高特异性活性的因子Ⅸ自然变异体,含有优化的AAV衣壳和肝脏特异表达调控基因片段)治疗患者,平均Ⅸ活性水平超过30%,10名治疗患者有8人完全停止因子Ⅸ输注。最近报道了血友病A的第一个早期阳性临床试验结果,7名患者中有6人的因子Ⅷ活性增加到正常范围或甚至高于正常范围。
AAV介导的血友病B和更常见的血友病A基因治疗的其他试验正在进行中。仍然需要解决的问题包括CD8+T细胞对衣壳的免疫反应,短疗程的类固醇激素只能控制一部分AAV载体的免疫反应;其次是有些病人存在AAV中和抗体,特别是成人。
眼科
在已经完成的随机对照Ⅲ期基因治疗试验中,携带rpe65突变的视力受损患者随机接受AAV2-RPE65的双侧注射一年后,治疗组患者的活动度、功能性视力测量以及某些视觉功能测试均显著改善。基于这一关键性研究,FDA顾问小组最近一致建议批准该药物。
目前正在对其他遗传性失明的临床试验进行AAV的直接注射,包括色盲、脉络膜瘤、Leber遗传性视神经病变、X-连锁视网膜裂和X-连锁视网膜色素变性。
神经肌肉
反义寡核苷酸药物Nusinersen彻底改变了因生存运动神经元1(SMN)基因功能突变而导致的儿童期脊髓肌萎缩(SMA)的治疗方法。鞘内输注nusinersen可调节脊髓运动神经元中SMN2基因的选择性剪接,产生的蛋白质能够补偿SMA1缺失。SMA的另一种基因疗法也显示出巨大的前景。一种携带SMN1基因、能有效穿过血脑屏障的AAV载体,单次静脉输注给15名婴幼儿后,所有受试者都存活至今,运动功能得到了改善。
退行性神经系统疾病是基因治疗的重点,但这类多基因、病理生理学复杂和机制不完全清楚的疾病比遗传性疾病更具挑战性。帕金森病(PD)一直是人们极力追求的目标。早期临床试验已经确定携带以下基因的AAV载体的安全性,包括芳香L-氨基酸脱羧酶基因(AADC,催化L-多巴转化为多巴胺)、谷氨酸脱羧酶基因(GAD,调节神经递质γ-氨基丁酸产生)和神经营养因子neurturin基因。
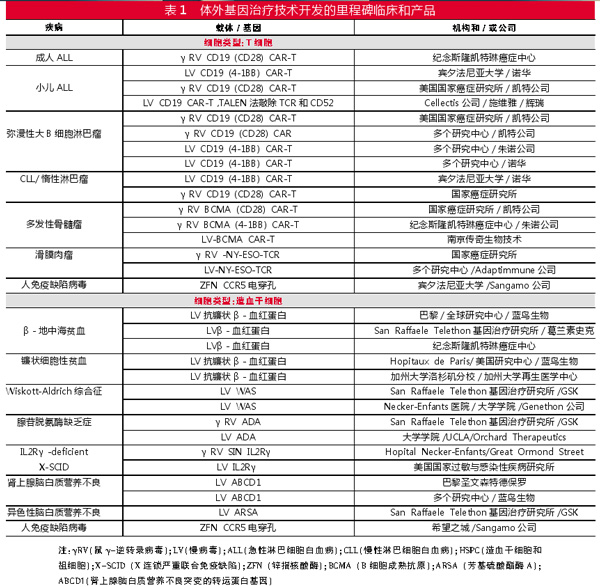
方向2:细胞体外基因改造
造血干细胞
体外改造的自体干细胞移植已用于严重联合免疫缺陷症、β-血红蛋白缺陷或血红蛋白病。与同种异体移植相比,自体移植的优点在于不需要组织相容供体,避免了移植物抗宿主反应(GVHD),因而不需要用免疫抑制剂。
1990年代末和2000年代初使用γ逆转录病毒载体的试验表明,编码白细胞介素-2受体γ或腺苷脱氨酶基因的基因治疗可明显改善重症联合免疫缺陷(SCID)患者的免疫功能。然而几年后,X-SCID、慢性肉芽肿性疾病和Wiskott-Aldrich综合征试验的患者,因原癌基因的激活而出现了急性髓性和淋巴性白血病。这些严重的毒性导致增强子删除慢病毒或增强子删除γ-逆转录病毒载体的应用。在X-SCID以及Wiskott-Aldrich综合征的试验中这些新载体的疗效令人鼓舞。
慢病毒载体更高的效率,使得基因疗法得到了更广泛的应用。肾上腺脑白质营养不良和溶酶体储存障碍性变色性白质营养不良导致儿童严重的神经退行性变和死亡。慢病毒基因治疗在这两种疾病中的临床试验都令人鼓舞。
目前已经开发出含有多种调节因子的慢病毒载体,可实现红系特异性血红蛋白的高水平表达,并且在β-地中海贫血或镰状细胞病患者中显示出前景。在不久的将来,通过重新激活内源性胎儿血红蛋白表达来治疗镰状细胞贫血的基因组编辑方法可能获得成功。
CAR疗法
CD19 CART在难治性急性淋巴细胞白血病(ALL)和弥漫性大B细胞淋巴瘤(DLBCL)中的临床获益,使得FDA批准了两种基因工程细胞产品。此外,还有其他CART治疗产品已获得FDA突破性指定用于治疗B细胞恶性肿瘤。
目前的研究挑战和方向是将CAR疗法扩展到骨髓恶性肿瘤和实体肿瘤。这些疾病存在挑战:一是因为可靠的实体肿瘤特异性细胞表面抗原尚未得到验证;二是还需要一种方法来促进Car-T细胞进入肿瘤组织,并克服不利于T细胞的肿瘤微环境信号。
目前,通用第三方Car-T细胞可以“现成”使用,与自体患者特异性T细胞相比,它可以实现更快速、更便宜的治疗。此外,缺乏内源性T细胞受体和/或主要组织相容性复合物分子以降低GVHD和排斥反应风险的T细胞方面的研发,也有很大的进展。
结论<<<
针对遗传性免疫疾病、血友病、眼睛疾病、神经退行性疾病和淋巴肿瘤等的其他基因疗法药,还将在不久的将来通过药品审评。
现在,基因疗法正在加速临床和商业发展。目前正在探索向患者提供体外基因治疗的各种模式,例如集中式或医院式的cGMP生产设施。此外,如何与政府和保险公司合作,对基因疗法开发出个性化的医保模式至关重要。“终身只需一次治疗”的基因治疗具有较高的前期成本,但对严重疾病患者具有长期效益。
比如在欧洲,虽有两种基因治疗产品已获得监管机构的批准,但由于价格昂贵、销售量太小,Uniqure公司的alipogene tiparvovec(一种用于治疗罕见遗传性脂蛋白脂酶缺乏患者的AAV1载体)已经退出市场,Strimvelis(γ-逆转录病毒载体的HSC基因疗法,用于治疗缺乏腺苷脱氨酶导致的SCID)也可能停止生产。
在美国情况较为乐观。美国医疗保险和医疗补助服务中心宣布,与第一个批准的CART制造商合作,以“基于结果”的方法决定价格,即只有患者最初对治疗有反应时才收取费用。
(篇幅所限,关于基因治疗基础研究技术升级的详情将随后刊出,敬请关注!)


此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。



