注射剂过评积极 首个过评品种有望后来居上
发布时间:2019-04-30 18:43:58作者:叶玲来源:医药经济报
注射剂过评积极
首个过评品种有望后来居上
备受瞩目的注射剂再评价已然开闸!截至4月17日,注射剂一致性评价已经通过(包含视同通过)的药品涉及13个受理号、9个通用名。注射剂一致性再评价无疑将对国内注射剂企业乃至整个医药行业的竞争格局产生重大影响。从全国百床以上医院数据统计来看,目前通过的品种涉及近160亿元的市场规模。
3月28日,CDE官网公布化学药仿制药参比制剂第二十一批目录。此次是继2017年10月8日中办国办印发《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,CDE于2017年12月22日即公开征求《已上市化学仿制药(注射剂)一致性评价技术要求》之后,首次有注射剂剂型产品进入参比制剂目录。对业界而言,这是注射剂一致性评价启动的一个信号。
那么,目前注射剂企业过评的积极性如何?已经过评的这些注射剂,是如何通过一致性评价的呢?将给相关领域的竞争格局带来怎样的影响?
1
通过路径解读
视同通过,有两种路径
根据《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》,在欧盟、美国或日本批准上市的仿制药已在中国上市并采用同一生产线同一处工艺生产的,申请人需提交境外上市申报的生物等效性研究、药学研究数据等技术材料,由国家药品监督管理局审评通过后,视同通过一致性评价。
目前视同通过的情形有以下两种:一是海内外共线品种;二是按照新注册申请上市。
视同通过的程序是:在中国境内用同一条生产线生产上市并在欧盟、美国或日本获准上市的药品(即海内外共线品种),由国家药监局受理和举报中心负责申报资料受理;对于按照新注册申请上市的仿制药,由一致性评价办公室通知药审中心对原境内、外上市申报资料进行审核,通知核查中心对生产现场进行检查。经一致性评价办公室审核批准视同通过一致性评价。
海内外共线品种
普利制药的注射用阿奇霉素属于海内外共线品种,按照政策,可以视同通过一致性评价。2018年8月,普利制药的注射用阿奇霉素进入《中国药品目录集》,类别是“通过质量和疗效一致性评价的药品”,显示批准日期是2018年5月15日。如果按照进入目录集的时间,该品种也是国内第一个正式通过(含视同)一致性评价的注射剂品种。
按照新注册申请上市
四川汇宇的注射用培美曲塞二钠同样属于海内外共线品种。不过,对比普利的注射用阿奇霉素,二者通过一致性评价的路径略有不同,四川汇宇是按照新注册申请上市的。
2016年3月发布的《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》指出,按照新注册分类申请上市的仿制药,获批后可以视同通过一致性评价。2017年10月17日,四川汇宇的注射用培美曲塞二钠获批。2017年12月29日,CDE宣布上线《中国上市药品目录集》,指出按照新注册分类申请获批上市的仿制药也在目录集收录范围。2018年5月22日,CDE在公布第4批通过一致性评价的药品清单时才首次明确指出,进入《中国上市药品目录集》的仿制药,允许在包装盒上使用“通过一致性评价”的标识。这才相当于将新4类仿制药与通过一致性评价之间划了等号。
四川汇宇的注射用培美曲塞二钠和多西他赛注射液在《中国上市药品目录集》中的收录类别都是“按化学药品新注册分类批准的仿制药”。
此外,石药集团和恒瑞医药的注射用紫杉醇(白蛋白结合型),也都是以“按化学药品新注册分类批准的仿制药”进入《中国上市药品目录集》,视同通过一致性评价。其中,恒瑞的注射用紫杉醇的CDE注册分类为6类,上市药品目录集收录类别为按化学药品新注册分类批准的仿制药。
其他企业注射剂一致性评价通过路径也逐渐明朗。苑东生物的布洛芬注射液、武汉大安的氟比洛芬酯注射液、恒瑞医药的注射用替莫唑胺、扬子江的盐酸右美托咪定注射液是按照新3类申报上市的仿制药,也就是仿制境外上市境内未上市原研药的仿制药。虽然分类不同,但是均按照新的注册分类,并且被收录到《中国上市药品目录集》,所以视同通过一致性评价。
大冢制药的注射用头孢唑林钠/氯化钠注射液是按照5.2类注册的进口仿制药,本质上跟新4类是一样的,也是获批后被收录到《中国上市药品目录集》,所以视同通过一致性评价。
2
过评者竞争格局
4品种有望后来者居上
9个过评注射剂品种中,海南普利的注射用阿奇霉素、四川汇宇的注射用培美曲塞二钠、四川汇宇的注射用多西他赛,以及扬子江药业的注射用右美托咪定这四个品种呈现同样的特点:原先市场份额较低,有望因首个过评创造奇迹,从而后来者居上。笔者对这四个品种市场竞争格局展开分析。
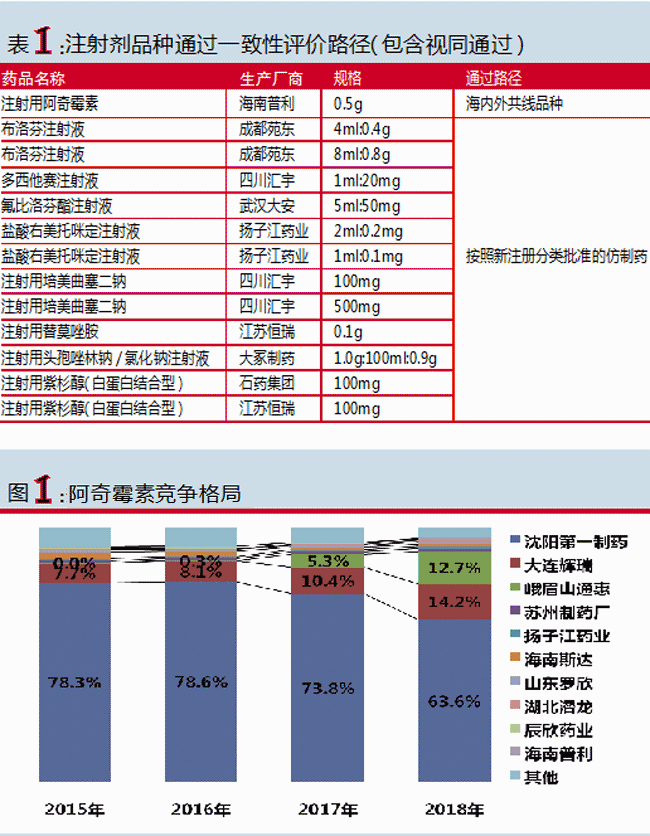
注射用阿奇霉素
首个过评企业:海南普利
普利制药的注射用阿奇霉素既是公司首个出口制剂转报国内成功获批的品种,也是迄今为止所有按照旧化药注册分类6类审批上市的注射剂中,首个正式通过一致性评价的注射剂品种。
据IQVIA数据统计,注射用阿奇霉素2018年全国百床以上医院市场规模为10.3亿元。虽然生产阿奇霉素注射剂的企业很多,但市场集中度较高,TOP3企业占据90.5%的市场份额。
从近几年数据看,2018年东北制药沈阳第一制药以63.6%的市场份额位居首位,原研厂家辉瑞以14.2%的占比紧随其后。从市场份额变化看,东北制药呈现占比逐步下降的态势,辉瑞的市场份额则有所上浮。
普利制药的注射用阿奇霉素在2018年全国百床以上医院市场规模为405万元,但此次通过一致性评价,则意味着普利有望获得有别于国内其他企业的质量层次,或将塑造新的市场格局。
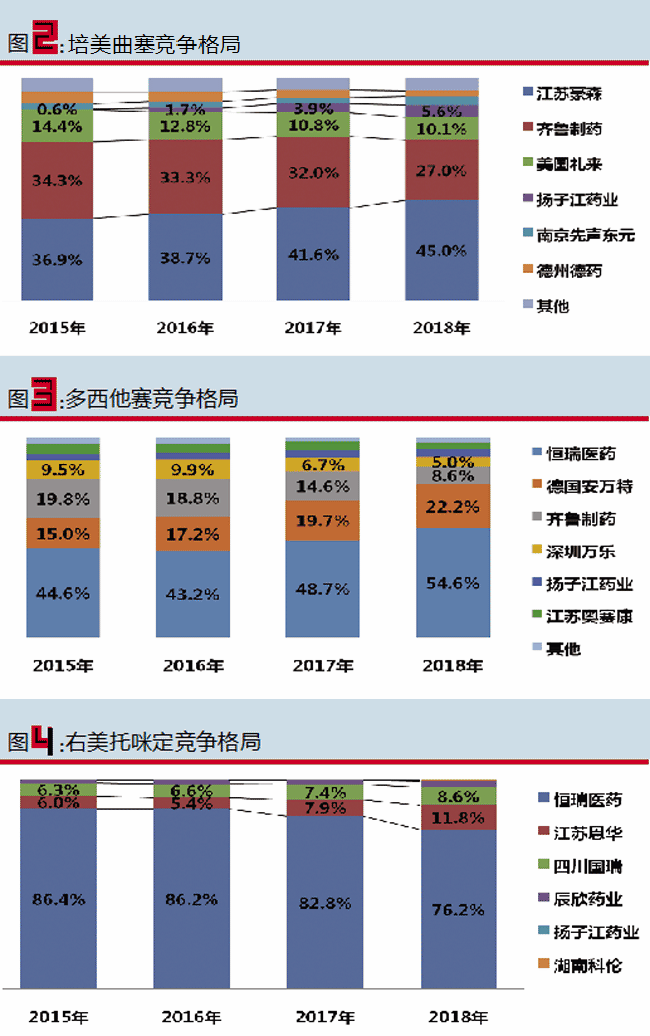
注射用培美曲塞二钠
首个过评企业:四川汇宇
注射用培美曲塞二钠原研厂家为礼来,2017年在全球的销售额为20.63亿美元。
2018年,注射用培美曲塞二钠全国百床以上医院销售额为36.4亿元,同比去年增长19.9%。在这接近40亿元的市场中,江苏豪森、齐鲁制药及礼来三大厂家瓜分82.2%的市场份额,其中江苏豪森独占45%的市场份额。
四川汇宇的培美曲塞在2018年全国百床以上医院市场规模为326万元,借助通过一致性评价的契机,有望提升市场份额。
注射用多西他赛
首个过评企业:四川汇宇
多西他赛是半合成的紫杉醇衍生物,原研企业为安万特公司,主要用于治疗晚期乳腺癌、卵巢癌、非小细胞肺癌等多种病症。
2018年,多西他赛全国百床以上医院市场规模已超30亿元,同比上一年增长5.5%。
多西他赛国内第一家仿制药企业是江苏恒瑞,市场集中度较高,恒瑞医药、齐鲁制药、安万特占据85%的市场份额,其中恒瑞医药以54.6%的比例遥遥领先于其他企业。
四川汇宇成为多西他赛首家通过一致性评价的药企,有望分得一杯羹,上市后将对多西他赛的市场格局产生一定的影响。
注射用右美托咪定
首个过评企业:扬子江药业
右美托咪定由芬兰公司Orion Pharma和美国公司Abott合作研制开发,于1999年12月获FDA批准其用于重症监护治疗患者气管插管和使用呼吸机期间的短期镇静(不超过24小时)。2008年,FDA又批准其可用于非插管患者在手术和其他操作前和/或术中的镇静。2009年江苏恒瑞作为首仿企业批准在中国上市。
据IQVIA数据统计,目前该药物2018年全国百床以上医院市场产生销售的国内企业已有6家,但70%以上市场仍掌控在首仿企业江苏恒瑞手中。
从近几年数据看,恒瑞市场占比呈现逐步下降的态势,江苏恩华的市场份额则有所上浮。扬子江药业的右美托咪定在2018年全国百床以上医院市场规模为1117万元,或将重塑市场格局。
3
最新申报情况
竞争激烈,过评动力大
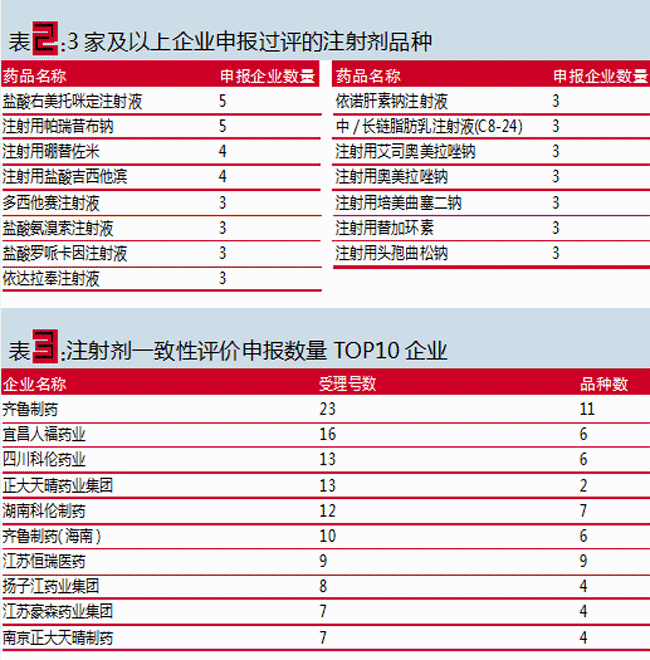
据医药魔方数据库统计,截至2019年4月19日,CDE共受理注射剂一致性受理号220个,涉及58家企业的82个品种。
其中,申报企业达三家及以上的品种15个,为注射用培美曲塞二钠、注射用硼替佐米、注射用地西他滨、注射用替加环素和注射用盐酸吉西他滨等;申报企业达2家的品种有14个;还有53个品种目前仅1家企业申报。
从注射剂一致性评价的申报企业来看,齐鲁制药无论受理号还是申报品种都遥遥领先。齐鲁制药有限公司有23个受理号11个品种,齐鲁制药(海南)有限公司有10个受理号6个品种,还有齐鲁天和惠世制药有限公司的1个品种,共计34个受理号18个注射剂品种申报一致性评价。
其次为正大天晴药业。正大天晴药业集团股份有限公司有13个受理号2个品种,南京正大天晴制药有限公司有7个受理号4个品种,共计20个受理号6个品种。
相比于固体制剂仿制药的一致性评价,注射剂一致性评价的竞争将更为激烈。这迫使相关注射剂生产企业进一步加快注射剂一致性评价的研究速度与推进力度,以期能在注射剂市场的竞争中占得一席之地。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。



