临床试验默许制启动 创新的春天来了吗?
发布时间:2019-04-30 15:53:43作者:本报特约撰稿 李弘来源:医药经济报
医疗器械临床试验审批从明示许可改为默示许可
临床试验默许制启动 创新的春天来了吗?
4月1日,国家药监局官网发布了关于调整医疗器械临床试验审批程序的公告(2019年第26号)。公告显示:“申请人在提出临床试验审批申请前,可以根据《关于需审批的医疗器械临床试验申请沟通交流有关事项的通告》与国家药品监督管理局医疗器械技术审评中心进行沟通。自临床试验审批申请受理并缴费之日起60个工作日内,申请人在预留联系方式、邮寄地址有效的前提下,未收到器审中心意见(包括专家咨询会议通知和补充资料通知)的,可以开展临床试验。对于同意开展临床试验的,器审中心将受理号、申请人名称和住所、试验用医疗器械名称、型号规格、结构及组成在器审中心网站公布,并将审查结果通过器审中心网站告知申请人,不再发放临床试验批件。”
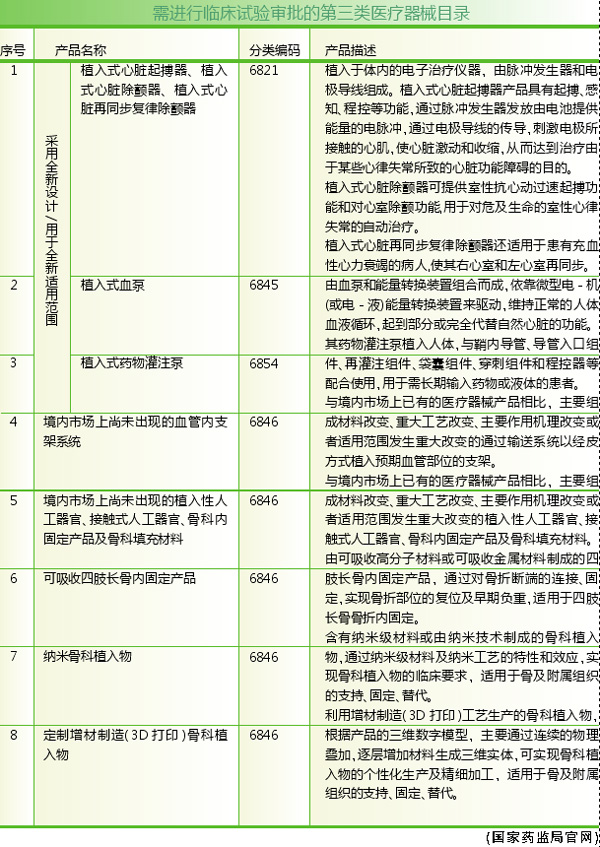
临床试验审批的初衷是为了保护医疗器械临床试验受试者的安全,规范高风险医疗器械临床试验的行为。从《需进行临床试验审批的第三类医疗器械目录》里不难看出(见表),所列出的八款器械均为具有较高临床风险的医疗器械。如由企业自行开展临床试验,如果产品不过关确实有可能对临床试验受试者产生危害。那么此次临床试验审批从明示许可改为默示许可的原因是什么,临床审批调整意义几何?
鼓励创新提速增效
临床试验审批流程的时限较长。受理、技术审评、行政许可、送达的时限分别为5、40、20和10个工作日,而审评阶段的发补不计入审评时限。对申报企业而言,资料准备已经耗费不少时间,再等上几个月甚至一年的临床试验审批时间,对企业的研发成本和项目周期形成了不小的挑战,甚至会挫伤企业投资研发创新医疗器械的积极性。
2017年10月,中共中央办公厅、国务院办公厅印发了《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,提出36项重要改革措施。提速增效、鼓励创新成为医疗器械审评审批制度改革的主要方向。随后发布的《〈医疗器械监督管理条例〉修正案(草案征求意见稿)》第二十二条也明确提出“第三类医疗器械进行临床试验对人体具有较高风险的,应当经国务院食品药品监督管理部门批准。国务院食品药品监督管理部门应当自受理相应临床试验申请之日起六十个工作日内决定是否同意开展临床试验;逾期未做决定的,注册申请人可以开展临床试验。临床试验对人体具有较高风险的第三类医疗器械目录由国务院食品药品监督管理部门制定、调整并公布。”显然,这则新条例草案中的红利此次已经以公告的形式提前落地,自发布之日起实施了。
风险管控更科学
临床试验审批由明示许可改为默示许可并不意味着取消审批,而是依据具体申报项目的风险进行科学审批。审评机构可以先对审批项目进行初评,选取较高风险的项目进行详细评审,审批结果可以在60个工作日内通知注册申请人。而对于初评认为风险较低的项目,可以酌情降低优先级直至默示许可。
再者,《医疗器械临床试验质量管理规范》于2016年6月1日实施,规范要求各级药监部门应采取有效措施,加强监督检查,督促本行政区域内医疗器械临床试验申办者和临床试验机构切实把规范的要求落实到临床试验管理的各个环节,保证临床试验过程科学规范,结果真实可靠,受试者合法权益得到充分保障。2018年开始,《医疗器械临床试验机构条件和备案管理办法》实施,临床试验机构纳入管理。2018年11月,国家药监局又发布了《医疗器械临床试验检查要点及判定原则》,意在加强医疗器械临床试验过程的监督管理,指导监管部门开展医疗器械临床试验监督检查工作。随着临床试验各项法规的落地,可以说,医疗器械临床试验的监管已从空白走向基本健全。
行业利好逐步释放
新版《医疗器械监督管理条例修正案(草案送审稿)》已向业界公布将近一年,其中医疗器械注册人制度试点、二类医疗器械豁免临床、审评审批权限调整等改革热点深受业界关注。此次临床试验审批改革提前落地也为新条例的种种利好逐步释放打开了想象空间。
在26号公告发布前的3月28日,国家药监局在北京召开医疗器械创新发展与审评审批改革座谈会,听取企业对创新医疗器械相关政策的意见和建议,了解鼓励创新医疗器械政策落实效果,研究进一步鼓励医疗器械创新发展工作思路。可以看出,监管层正在积极落实创新意见的要求,积极推动医疗器械的各项改革工作。笔者也期待企业和监管层能携手努力,为新版医疗器械监督管理条例尽早落地,为我国医疗器械产业创新发展持续繁荣开创新局面。
链接>>
临床试验审批的法规依据
2014年3月,《医疗器械监督管理条例》(国务院650号令)发布,其中第十九条明确规定“第三类医疗器械进行临床试验对人体具有较高风险的,应当经国务院食品药品监督管理部门批准。临床试验对人体具有较高风险的第三类医疗器械目录由国务院食品药品监督管理部门制定、调整并公布。国务院食品药品监督管理部门审批临床试验,应当对拟承担医疗器械临床试验的机构的设备、专业人员等条件、该医疗器械的风险程度、临床试验实施方案、临床受益与风险对比分析报告等进行综合分析。准予开展临床试验的,应当通报临床试验提出者以及临床试验机构所在地省、自治区、直辖市人民政府食品药品监督管理部门和卫生计生主管部门。”
2014年8月,原国家食品药品监督管理总局发布了《需进行临床试验审批的第三类医疗器械目录》,共有八款医疗器械进入目录,包括植入式心脏起搏器、植入式血泵、植入式药物灌注泵、境内首创型血管支架、植入性人工器官及使用创新材料的骨科植入器械等。为了便于企业申请临床审批,国家局还发布了第三类高风险医疗器械临床试验审批服务指南、无源植入性医疗器械临床试验审批申报资料编写指导原则及关于需审批的医疗器械临床试验申请沟通交流有关事项的通告等配套文件。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。



