跑步进场的罕见病新药
发布时间:2019-03-12 19:14:04作者:本报特约撰稿 边界来源:医药经济报
跑步进场的罕见病新药
聚焦已在欧美上市、未在国内上市的孤儿药
2月28日,《罕见病诊疗指南(2019年版)》正式发布。共公布了121个罕见病,与2018年5月22日发布的《第一批罕见病目录》相一致。《罕见病诊疗指南(2019年版)》和罕见病药降税等政策,将为患者带来新的治疗选择并为患者减负。
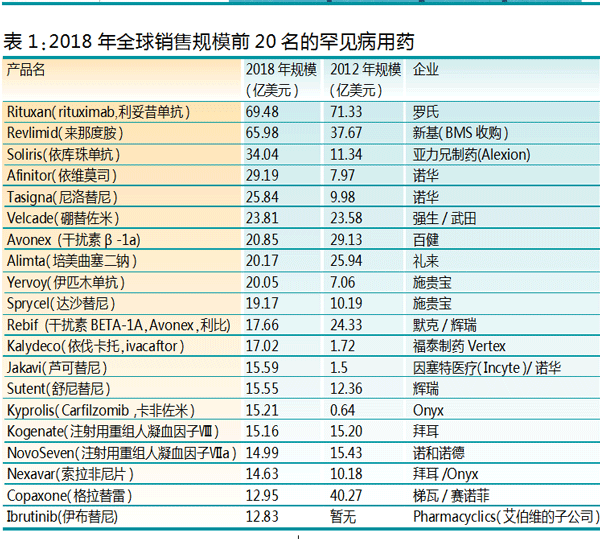
在国外,罕见病药市场并不差,前20名的产品市场规模都超过了10亿美元(见表1)。此外,前20的罕见病用药中,除了Yervoy(伊匹木单抗)、Kalydeco(依伐卡托,ivacaftor)、Kyprolis(Carfilzomib,卡非佐米)和Copaxone(格拉替雷)之外,其他都已在我国上市。
在我国,罕见病药的市场才开始起步。2018年年终,我国批准了不少罕见病用药,如治疗肺动脉高压的司来帕格片、用于治疗成人和儿童阵发性睡眠性血红蛋白尿症(PNH)和非典型溶血性尿毒症综合征(aHUS)的依库珠单抗、用于治疗存在凝血因子Ⅷ抑制物的A型血友病患者的艾美赛珠单抗注射液。
笔者分析《罕见病诊疗指南(2019年版)》中已在欧美上市、但国内暂未上市的产品,对应于10种罕见病。
1 Castleman病
关注新药:司妥昔单抗
Castleman病(Castleman disease,CD)又称巨大淋巴结病或血管滤泡性淋巴结增生症,是一种较为少见的淋巴增生性疾病。
司妥昔单抗为抗白介素-6嵌合型单抗,是目前唯一获得FDA批准的多中心型CD治疗药物,已在40多个国家上市。
国内方面,西安杨森已获批临床,但暂未申报上市。
2 遗传性血管性水肿
关注新药:C1酯酶抑制剂、缓激肽受体拮抗剂、血浆激肽释放酶抑制剂
遗传性血管性水肿(Hereditary Angioedema,HAE)是一种常染色体显性遗传病。主要表现为皮肤和黏膜水肿,急性期主要表现为UAE及胃肠道水肿发作。
尽管HAE发病率较低,但由于约半数患者可出现上呼吸道黏膜水肿(upper airway angioedema,UAE)而引发窒息而危及生命,因此对HAE的预防和治疗尤为重要。急性期治疗的适应证为UAE及胃肠道水肿发作,目的在于缓解症状。
急性期治疗主要药物包括:①C1酯酶抑制剂(C1-INH)替代疗法,包括血源性C1-INH(pd-C1-INH)和重组人C1-INH(rh C1-INH);②缓激肽受体拮抗剂爱替班特(Icatibant)、血浆激肽释放酶抑制剂艾卡拉肽(ecallantide)。这些药物对HAE的急性发作均起到很好的控制作用,美国FDA已经批准,但目前在我国均未上市。
国外用于预防的药物包括C1酯酶抑制剂,已获得FDA批准用于青少年及成年HAE患者的预防性治疗,常见不良反应有上呼吸道感染、皮疹、头痛、鼻窦炎。FDA也批准了血浆激肽释放酶全人源单克隆抗体Lanadelumab,用于12岁以上的患者长期预防,获得满意疗效,而且安全性好,为HAE的长期预防提供了新选择。
上述产品除了爱替班特(Icatibant)目前有成都圣诺生物制药和江苏豪森申报外,其余产品暂无厂家申报。
3 进行性肌营养不良
关注新药:外显子51跳跃药物
进行性肌营养不良是一组以骨骼肌进行性无力萎缩为主要临床表现的异质性基因缺陷性疾病,可伴有中枢神经系统、心脏、骨骼、呼吸及胃肠道受累。
随着基因治疗、细胞治疗的快速发展,Duchenne型肌营养不良已有新的基因治疗药物,如外显子51跳跃药物eteplirsen(Exondys51)已被FDA批准上市。适用范围更广的AAV载体导入外源截短dystrophin蛋白的基因治疗临床试验正在开展。其他如基因编辑、干细胞治疗、其他调整药物等也都在快速推进中。
eteplirsen在我国暂未有厂家申报。
4 囊性纤维化
关注新药:依伐卡托(ivacaftor)、鲁玛卡托(lumicaftor)
囊性纤维化(pulmonary cystic fibrosis,CF)是由囊性纤维化跨膜传导调节因子(CFTR)基因突变导致的多系统疾病。以反复的呼吸道感染、咳嗽、咳痰和呼吸困难为特征,还可以出现鼻窦炎、生长发育障碍、脂肪泻和男性不育等症状,是高加索人种最常见的遗传疾病之一。
随着对CFTR基因的深入研究,治疗开始针对解决CFTR基因缺陷的源头问题。CFTR调节剂通过改善缺陷的CFTR蛋白功能而发挥作用。代表性药物为依伐卡托(ivacaftor),于2012年1月经美国FDA批准上市,是首个获准用于CF治疗的药物,它能够修复突变CF蛋白的功能,其作用的程度和广度都显著超过了当前可用于CF的任何其他疗法。依伐卡托适用的突变靶点除了最初研发的G551D之外,还可用于G178R、S549N、S549R、G551S、G1244E、S1251N、S1255P、G1349D或R117H。
对于ΔF508纯合突变的患者,鲁玛卡托(lumicaftor)联合依伐卡托(2015年7月,FDA批准复方药物上市)能够轻度改善肺功能,并降低肺部疾病加重的风险。
5 酪氨酸血症
关注新药:尼替西农
酪氨酸血症(tyrosinemia)是由于酪氨酸代谢途径中的酶缺陷引起的血浆中酪氨酸浓度增高,不同步骤的酶的缺陷可导致多种临床表现不同的疾病。酪氨酸血症分为3种类型,其中酪氨酸血症Ⅰ型也被称为肝肾酪氨酸血症(HT-1),为延胡索酰乙酰乙酸水解酶(FAH)缺陷所致,以肝、肾和周围神经病变为特征。酪氨酸血症Ⅰ型病例报道相对较多,且对健康危害较大。
酪氨酸血症Ⅰ型是一种可治疗的遗传代谢病,HPPD抑制剂尼替西农(NTBC)可防止毒性极大的马来酰乙酰乙酸、延胡索酰乙酰乙酸及其旁路代谢产物琥珀酰丙酮蓄积,从而减轻肝肾功能损伤,使症状得到缓解,明显改善远期预后,提高生存率,并可降低肝细胞癌的发生率。
尼替西农目前仅郑州大明药物科技有限公司申报并获批临床,但暂无临床信息。
6 戈谢病
关注新药:依利格鲁特
戈谢病是较常见的溶酶体贮积病,为常染色体隐性遗传病。该病由于葡萄糖脑苷脂酶基因突变导致机体葡萄糖脑苷脂酶(又称酸性β-葡萄糖苷酶)活性缺乏,造成其底物葡萄糖脑苷脂在肝、脾、骨骼、肺,甚至脑的巨噬细胞溶酶体中贮积,形成典型的贮积细胞即“戈谢细胞”,导致受累组织器官出现病变,临床表现多脏器受累并呈进行性加重。
戈谢病可采取非特异性治疗的底物减少疗法,即减少葡萄糖神经酰胺的合成。底物减少疗法药物目前有健赞的Cerdelga(eliglustat tartrate,依利格鲁特),已于2014年美国上市、2015年在欧洲上市。
目前底物减少疗法药物尚未在我国上市。健赞曾在国内申报临床;2018年北京凯莱天成启动依利格鲁司他胶囊人体生物等效性研究。
7 纯合子家族性高胆固醇血症
关注新药:阿利库单抗、洛美他派、米泊美生钠
家族性高胆固醇血症(familial hypercholesterolemia,FH)是由低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)分解代谢的关键基因之一发生突变引起的一种遗传性疾病。其中,纯合子家族性高胆固醇血症(HoFH)是由于这些关键基因发生纯合突变或复合性杂合突变所致,临床表现为LDL-C水平明显升高,胆固醇在皮肤、眼睛和肌腱等多处沉积和早发动脉粥样硬化性心血管疾病(ASCVD)的倾向。
目前他汀类药物是HoFH的主要治疗方法,但即使最大剂量的他汀,血浆LDL-C水平也只能达到中等程度的下降,多数患者的LDL-C仅降低10%~25%。加用胆固醇吸收抑制剂依折麦布可使LDL-C进一步降低10%~15%。他汀与其他降低胆固醇药物的联合使用可进一步降低LDL-C水平,包括胆汁酸螯合剂、烟酸、贝特类和普罗布考,但较多副作用又限制了这些药物的使用。
PCSK9的单克隆抗体可以在他汀类药物的基础上使血LDL-C进一步降低50%~70%,并呈剂量依赖性,从而降低FH患者的全因死亡率和心血管病死率。
目前,已有2种PCSK9的单克隆抗体在美国和欧洲被批准用于HoFH患者,分别为阿利库单抗(alirocumab)和依洛尤单抗注射液(evolocumab)。
此外,洛美他派(lomitapide)和米泊美生钠(mipomersen)最近被FDA批准,分别用于≥18岁和≥12岁的HoFH患者的辅助治疗。洛美他派是微粒体甘油三酯转运蛋白的口服抑制剂,通过减少极低密度脂蛋白的合成可降低血LDL-C水平约50%。米泊美生是一种针对ApoB mRNA的第二代反义寡核苷酸,可减少ApoB的合成,降低血LDL-C的水平,无论单用还是与他汀类联合使用均可使血LDL-C降低25%~37%。
国内方面,安进的依洛尤单抗注射液已于2018年在国内上市。赛诺菲的阿利库单抗(alirocumab)已获批临床,2016年已启动高胆固醇血症和急性冠脉综合征适应症研究。洛美他派(lomitapide)和米泊美生钠(mipomersen)暂未有厂家申报。
8 高苯丙氨酸血症
关注新药:苯丙氨酸解氨酶
高苯丙氨酸血症(hyperphenylalaninemia,HPA)是由于苯丙氨酸羟化酶(Phenylalanine Hydroxylase,PAH)缺乏或其辅酶四氢生物蝶呤(BH4)缺乏,导致血苯丙氨酸(PHE)增高的一组氨基酸代谢病。
由于PKU长期饮食治疗依从性下降、无PHE食物口味欠佳、特殊饮食易导致营养缺乏等问题,饮食治疗常面临挑战。其他治疗方法包括大分子中性氨基酸(LNAA)、奶酪乳清提取的低PHE的天然蛋白质糖巨肽(GMP)的应用。苯丙氨酸解氨酶(PAL)已在美国批准临床应用,酶替代疗法、基因治疗等处于试验阶段。
苯丙氨酸解氨酶国内暂无厂家申报。
9 溶酶体酸性脂肪酶缺乏症
关注新药:Sebelipase alfa
溶酶体酸性脂肪酶缺乏症(Lysosomal Acid Lipase Deficiency,LALD)是由于LIPA基因突变使溶酶体酸性脂肪酶缺乏,导致胆固醇酯和三酰甘油在肝、脾、肾上腺及心血管系统等组织贮积,为罕见的常染色体隐性遗传病。
2015年底,美国批准Kanuma(sebelipase alfa)为首个溶酶体酸性脂肪酶缺乏症酶替代药物。sebelipase是重组人溶酶体酸性脂肪酶,为静脉途径给药,可改善血脂异常、改善肝功能异常、减轻肝脏组织学变化,并改善胃肠道症状、改善生长发育、延长生存时间、提高生活质量,并且副作用小。
Sebelipase alfa在我国暂未有厂家申报。
10 脊髓性肌萎缩症
关注新药:Spinraza
脊髓性肌萎缩症(Spinal Muscular Atrophy,SMA)是由于运动神经元存活基因1(survival motor neuron gene 1,SMN1)突变导致SMN蛋白功能缺陷所致的遗传性神经肌肉病。SMA以脊髓前角运动神经元退化变性和丢失导致的肌无力和肌萎缩为主要临床特征。
Spinraza(nusinersen)是一种在Ⅰ型和Ⅱ型SMA中完成Ⅲ期临床试验的反义寡核苷酸药物,2016年获得FDA和EMA批准用于治疗各型SMA,并已在多个国家投放上市。虽然前期参与的患者和家属表示药物的临床结果非常好,但由于是通过鞘内给药,因此要求医疗机构具备相应设施才能完成给药并实施术后监测。其他如旨在提升SMN蛋白水平的小分子药物或使用病毒载体的SMN1基因替代疗法,已进行临床试验并取得了初步可喜的疗效。
在国内,Spinraza于2018年申报报产,2019年2月26日审批完毕,预计2019年获批生产。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。



