首个国产生物类似药花落谁家
发布时间:2019-01-24 13:01:49作者:一诺来源:医药经济报
近年来,全球生物类似药开发主要集中在一系列专利已经或即将到期的生物制剂,包括阿达木单抗、英夫利昔单抗、利妥昔单抗、贝伐珠单抗、曲妥珠单抗等。单抗药物在全球市场发展迅速,国内药企也纷纷布局,竞相角逐这个快速增长的领域,中国生物类似药迎来了蓬勃发展的好时代。
国产生物类似药发展趋势大好,国内首个获批生物类似药将会花落谁家,让我们拭目以待。下面重点介绍国内几种处于提交上市申请阶段的重磅单抗品种。
【现状】
政策利好
近年来,我国制定和颁布了多项生物类似药相关政策,希望借助生物类似药来打破单抗类似药长期依赖进口的现状。2014年12月,国家药监局颁布了《生物类似药研发与技术指导原则(征求意见稿)》;2015年2月,颁布了《生物类似药研发与技术指导原则(试行)》;2016年7月,《药品注册管理办法(修订稿)》进一步规范生物类似药的概念和审批标准;2017年10 月,两办联合发布的《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》再一次明确提出支持生物类似药发展。
这些政策的陆续出台,对于我国生物类似药的开发具有极其重要的指导意义,同时也标志着我国生物类似药审批政策已经逐渐与国际接轨。
百花齐放
目前国内已有多家药企的生物类似药处于提交上市申请阶段,主要有复宏汉霖的利妥昔单抗类似药HLX01、齐鲁制药的贝伐珠单抗类似药QL1101、三生国健的曲妥珠单抗类似药注射用重组抗HER2人源化单克隆抗体(302H)、百迈博的英夫利昔单抗类似药CMAB-008等。此外,阿达木单抗类似药有百奥泰的BAT1406、海正药业的HS016、信达生物三家企业的IBI303。另有多家企业的产品已处于Ⅲ期临床阶段。
【重点品种】
利妥昔单抗
原研企业:罗氏
国内提交上市申请:复宏汉霖
利妥昔单抗由罗氏开发,商品名为“Rituxan”,1997年和1998年先后被FDA和EMA批准上市,主要适应症为非霍奇金淋巴瘤、慢性淋巴细胞白血病和类风湿关节炎。目前欧盟已批准两种利妥昔单抗生物类似药:Celltrion 公司的Truxima及诺华旗下Sandoz公司的Rixathon/Riximyo。
{全球市场}
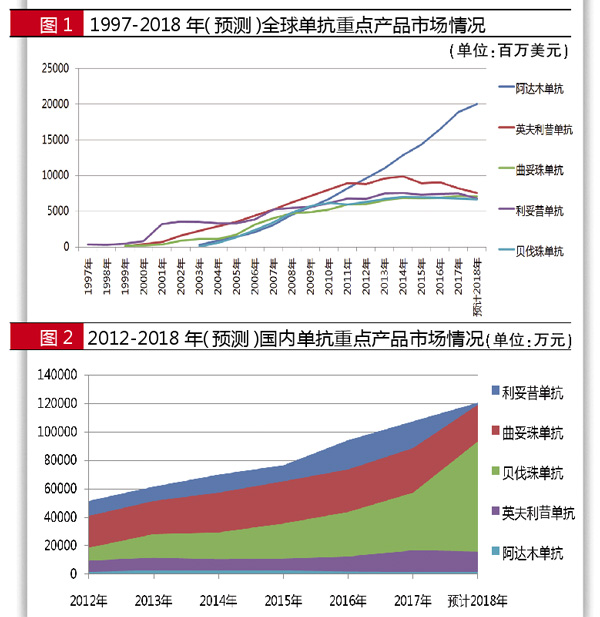
据全球畅销药数据统计,1998年利妥昔单抗销售额为3.2亿美元,2007年销售额过50亿美元,2017年销售额达75亿美元,2007-2017年已连续11年销售额过50亿美元。
从1998-2017年销售情况来看,该产品累计销售额高达958亿美元,至今仍是CD20单抗领域的霸主产品。2018年前三季度,利妥昔单抗全球销售额为50.93亿美元,预计全年销售额为68亿美元。
{国内市场}
2000年,罗氏的利妥昔单抗在我国进口上市,商品名为美罗华,剂型为注射液,规格为100mg/10ml、500mg/50ml,在中国批准非霍奇金淋巴瘤适应症。
据国内样本医院数据统计,利妥昔单抗2012年用药金额为5.16亿元,2017年为10.8亿元。2018年前三季度国内样本医院用药金额为9.1亿元,预计2018年用药金额将超过12.0亿元。该产品是罗氏在中国最畅销的药品,2017年医保准入谈判后,利妥昔单抗降价幅度高达58.45%,之后市场迅速放量。
{申报情况}
目前国内利妥昔单抗类似药申报企业已有十几家,研发进度最快的是复宏汉霖,已经处于申请上市阶段。另有信达生物、神州细胞工程、喜康生物、海正药业4家公司的产品进入临床Ⅲ期,中信国健撤回。
2018年1月,复宏汉霖利妥昔单抗注射剂治疗非霍奇金淋巴瘤和类风湿关节炎的上市申请被列入优先审评。
点评:这是中国首个申请上市的生物类似药,预计也将成为第一个进入市场的国产生物类似药,极有可能在2019年上半年获批。
曲妥珠单抗
原研企业:罗氏
国内提交上市申请:三生国健
曲妥珠单抗由罗氏公司生产,商品名为“Hercepti”,1998年经过FDA批准,此后分别于2000年和2001年在欧洲和日本获批。
目前,全球只有两种曲妥珠单抗生物类似药上市,分别是:FDA批准Mylan/Biocon开发的Ogivri及EMA批准三星生物的Ontruzant。
{全球市场}
据全球畅销药数据统计,1999年曲妥珠单抗销售额为1.88亿美元,2003年销售额过10亿美元,2006年销售额过30亿美元,2010年销售额过50亿美元, 2017年销售额71.27亿美元。1997-2017年,该产品累计销售额高达705亿美元。2018年前三季度,曲妥珠单抗全球销售额为52.89亿美元,预计全年销售额为71亿美元。
{国内市场}
2002年9月,罗氏的曲妥珠单抗获批进入中国,商品名为赫赛汀,在国内获批治疗HER2阳性乳腺癌、HER2阳性胃癌,剂型为粉针剂,规格为440mg、150mg。
据国内样本医院数据统计,曲妥珠单抗2012年用药金额为4.10亿元,2016年用药金额为7.37亿元,2017年用药金额为8.87亿元,较同期增长20.4%。2018年前三季度,曲妥珠单抗整体市场为8.9亿元,预计2018年用药金额超过12.0亿元。2017年曲妥珠单抗通过价格谈判进入医保目录,降价幅度达 65%。2018年版基药数量扩容,曲妥珠单抗进入其中。
{申报情况}
目前国内申报曲妥珠单抗类似药的企业有10多家,研发进度最快的三生国健,已提交上市申请,商品名为赛普汀。另有嘉和生物、正大天晴、复宏汉霖、安科生物和海正药业5家企业的产品进入Ⅲ期临床。
点评:三生国健的曲妥珠单抗生物类似药有望首个获批,随着医保范围的不断扩容,未来市场规模有望快速增长。
阿达木单抗
原研企业:艾伯维
国内提交上市申请:百奥泰、海正药业、信达生物
阿达木单抗由艾伯维研发,商品名为“Humira”,2002年12月获FDA批准,2003年9月获EMA批准,2008年4月获PMDA批准。获批适应症主要包括强直性脊柱炎、克罗恩病、银屑病、幼年特发性关节炎、银屑病关节炎、溃疡性结肠炎、皮肤化脓性汗腺炎、葡萄膜炎。该药已在全球90多个国家获批上市。
目前,美国已批准了三种阿达木单抗生物类似药:安进的Amjevita、勃林格殷格翰的Cyltezo、Sandoz的Hyrimoz。欧盟批准了4个:Amgevita和Cyltezo以及安进的Solymbic和三星生物的Imraldi。
{全球市场}
据全球畅销药数据统计,2003年阿达木单抗销售额为2.8亿美元,2005年过10亿美元,2006年过20亿美元,2009年过50亿美元,2013年过100亿美元,2016年过150亿美元,2017年销售额189.08亿美元。2003-2017年该产品累计销售额已高达1159亿美元,连续六年稳坐全球“药王”宝座。2018年前三季度,阿达木单抗全球销售额为150.18亿美元,预计全年销售额超过200亿美元。
{国内市场}
2009年,艾伯维的阿达木单抗在我国获批上市,商品名为修美乐,剂型为注射液,规格为140mg/0.8ml 。
据国内样本医院数据统计,阿达木单抗2012年用药金额为1809万元,2016年为2208万元,2017年为1795万元,较同期下降11.5%。2018年前三季度,阿达木单抗用药金额为1209万元,预计2018年用药金额超过1700万元。
对比全球市场,阿达木单抗目前在中国的销售情况并不理想,随着更多适应症在国内上市,市场潜力依然巨大。
{申报情况}
当前,国内申报阿达木单抗类似药的企业已有20多家,研发进度最快的是百奥泰、海正和信达生物,已经处于申请上市阶段。另有复宏汉霖、君实生物、正大天晴的产品进入临床Ⅲ期。
点评:国内三家企业争夺阿达木单抗生物类似药首仿资格的争夺战越发激烈。一旦首仿上市,将会凭借价格优势拥有一席之地。
贝伐珠单抗
原研企业:罗氏
国内提交上市申请:齐鲁制药
贝伐珠单抗由罗氏旗下基因泰克开发,商品名为“Avastin”。该药于2004年2月和2005年1月相继获得FDA和EMA的批准。目前已获得结直肠癌、非小细胞肺癌、胶质母细胞瘤、肾细胞癌、宫颈癌、卵巢癌、输卵管癌、腹膜癌等多个实体瘤适应症。
目前,全球市场上只有一种贝伐珠单抗生物类似药,即由安进和艾尔建联合开发的Mvasi,已经在美国和欧盟上市。
{全球市场}
据全球畅销药数据统计,2005年贝伐珠单抗销售额为1.88亿美元,2002年销售额突破10亿美元大关,2006年突破30亿美元,2010年突破50亿美元,此后连续8年销售额居于60亿~70亿美元之间。
该药1999-2017年累计销售额为712亿美元。2018年前三季度,贝伐珠单抗全球市场销售额为50.09亿美元,预计全年销售额为67亿美元。
贝伐珠单抗的欧洲专利保护于2018年到期,美国专利保护将于2019年到期,该药已成为国内外热门仿制产品。
{国内市场}
2010年2月,罗氏的贝伐珠单抗获批在我国上市,商品名为安维汀,主要用于治疗转移性结直肠癌和晚期、转移性或复发性非小细胞肺癌。剂型为注射液,规格为100mg(4ml)、400mg(16ml)两种。
据国内样本医院数据统计,贝伐珠单抗2012年用药金额为1.86亿元,2013年为2.82亿元, 2016年为4.34亿元,2017年为5.73亿元,较同期增长30.9%。2018年前三季度,贝伐珠单抗用药金额为7.0亿元,预计2018年将超过9.5亿元。
2017年,贝伐珠单抗通过价格谈判进入国家医保目录,降价幅度达62%,随着医保政策红利释放,市场快速增长。
{申报情况}
目前国内申报贝伐珠单抗类似药的企业已有20多家,研发进度最快的是齐鲁制药,已经处于申请上市阶段。另有信达生物、东曜药业、北京天广实生物、正大天晴、恒瑞、绿叶制药、百奥泰、嘉和生物的产品进入临床Ⅲ期。
点评:齐鲁制药的重组抗VEGF人源化单克隆抗体注射液作为重大专项品种纳入第三十三批优先审评名单。如能拔得头筹,将有助于推动该企业肿瘤产品线的快速增长。
英夫利昔单抗
原研企业:强生
国内提交上市申请:百迈博
英夫利昔单抗由美国强生公司杨森开发,商品名为“Remicade”,于1998年和1999年8月先后获FDA和EMA批准。目前主要获批用于治疗炎症相关疾病,包括克罗恩病、溃疡性结肠炎、类风湿性关节炎、强直性脊柱炎、牛皮癣性关节炎和斑块型牛皮癣。该药欧洲专利已于2014年到期,美国专利2018年到期。
目前,美国只有3种英夫利昔单抗生物类似药获批,分别是:辉瑞/Celltrion的Inflectra、辉瑞的Ixifi、三星的Renflexis。EMA则批准了3款产品,辉瑞的Inflectra、Celltrion的Remsima和三星的Flixabi。
{全球市场}
据全球畅销药数据统计,1999年英夫利昔单抗销售额为1.46亿美元,2002年突破15亿美元,2003年突破20亿美元,2005年突破30亿美元,2007年突破50亿美元,此后连续10年销售额居于60亿~80亿美元之间,2017年销售额为82.16亿美元。
{国内市场}
2007年,强生的英夫利昔单抗在我国进口上市,商品名为类克,剂型为粉针剂,规格为100mg,在中国获批银屑病适应症。
据国内样本医院数据统计,英夫利昔单抗2012年销售额为9561万元,2016年销售额为1.24亿元,2017年销售额为1.68亿元,较同期增长35.3%。2018年前三季度,英夫利昔单抗国内样本医院用药金额为1.2亿元,预计2018年用药金额超过1.6亿元。
{申报情况}
目前国内申报英夫利昔单抗生物类似药的企业中,研发进度最快的是百迈博,已经处于申请上市阶段。另有海正药业、嘉和生物两家公司的产品进入临床Ⅲ期。
点评:该产品未进入国家医保目录且价格高昂,加上没有获批单独用于治疗类风湿性关节炎,临床使用受到限制。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。



