日澳罕用药定价制度对比
发布时间:2019-01-23 17:20:20作者:张方 李彤彤(沈阳药科大学工商管理学院)来源:医药经济报
罕见病药物全球定价分析(二)
1月17日,本版介绍了美国对罕见病药物实行市场自由定价制度,在激发药企研发热情的同时,也衍生出一些问题;欧盟各成员国对罕见病药物实行自主定价,因此,罕见病药物价格在各成员国之间存在一定的差异。本期我们将对日本和澳大利亚两国的罕见病用药定价制度作一介绍。
日本:政府统一管理
通过日本上市批准的罕用药大多为新药。若该罕用药有类似品,则采用类似药效比较方式(Ⅰ)计算;反之,则采用成本计算方式计算
日本药品价格主要由政府进行统一管理,厚生劳动省(MHLW)负责包括罕用药在内的日本所有药品的上市审批、价格制定以及偿付报销等一系列相关工作,具体由厚生劳动省下属的医政局经济课负责药品价格管理。日本实行药价基准制度,即由厚生劳动省统一管理医疗保险药品目录内的药品和具体价格。
与法国、意大利等国家相似,日本的药品价格制定与药品偿付报销情况紧密相关。根据药品是否获得偿付报销分为两种定价方式:若药品被纳入到医疗保险药品目录(获得偿付报销),则由政府有关部门制定价格,并与制药企业进行协商;若未纳入到医疗保险药品目录(未获得偿付报销),由制药企业自行定价。日本为全民医保国家,大部分药品都被纳入医疗保险药品目录,通过日本上市批准的罕用药大多为新药。因此,本小节有关日本的罕用药定价情况主要围绕日本药价基准内的新药进行阐述。
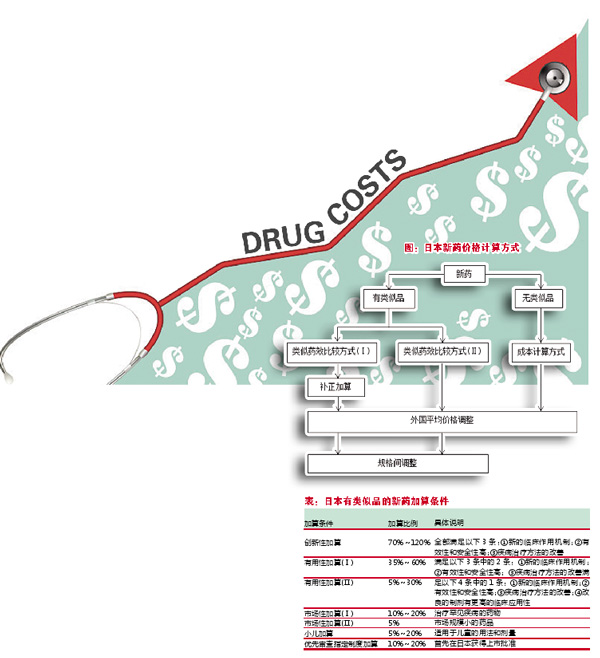
日本将药价基准内的药品分为新药、仿制药两类,采取不同方式进行定价。新药价格根据新药有无类似品分为两类进行定价,若该新药有类似品,则采用类似品计算方式进行定价;若该新药无类似品,则采取成本计算方式进行定价。日本新药价格的计算方式如图所示。
类似品计算方式根据是否具有加算条件分为两种,即类似药效比较方式(Ⅰ)与类似药效比较方式(Ⅱ)。若该新药有类似品且具备加算条件,则采取类似药效比较方式(Ⅰ)。以现有类似品的一日所需药费为基准,如果新药的用途优于类似药,则在该基准上进行补正加算。具体加算条件说明如表所示。
若该新药有类似品但不具备加算条件,则采取类似药效比较方式(Ⅱ),具体计算方式为选取十年内类似药品的平均价格或六年内类似药品的最低价格。若该新药无类似品,则根据所需成本、营业收益、消费税等相关费用进行计算。初步药价计算完成之后,将对比参照其它国家药品的平均价格进行调整。当有类似品的新药存在规格改进时,将相应进行规格间调整。日本对药品价格控制较为严格,根据现行市场价格,每两年对药价基准内的药品进行一次修订,但罕见病药物不纳入到修订调整范围内。
综合上述,从新药计算方式可知:
①若该罕用药有类似品,则采用类似药效比较方式(Ⅰ)计算。具体包括五种情况:1)因是罕用药,可享受 10%~20%的市场性加算(Ⅰ); 2)依据罕用药定义“当前无替代药品,或该药品具有更优越的有效性或安全性”,罕用药可享受5%~30%的有用性加算(Ⅱ),甚至是35%~60%的有用性加算(Ⅰ);3)罕用药用于治疗少于 5万人的疾病,有可能享受到5%的市场性加算(Ⅱ);4)若某罕用药用于治疗儿科疾病,可享受5%~20%的小儿加算;5)若某罕用药首先在日本获得上市批准,可享受10%~20%的优先审查加算;
②若该罕用药无类似品,则采用成本计算方式。基于以上加算条件,以及罕用药不在修订调整范围内,罕用药价格可能高于其他普通药品。此外日本规定,获得研发资助的制药企业在上市销售后,需要将一部分药品销售收益作为缴纳金,返还给相关机构,用于资助其它罕用药研发项目。每年支付的缴纳金为:

需缴纳10年,缴纳金总额不超过所获得的资助总额。
澳大利亚:
PBPA定价衡量八因素
澳大利亚PBS覆盖了包括罕用药在内的大部分药品,PBPA在制定某药品价格时,通常考虑成本信息、处方量、规模经济等多项因素
与日本相似,澳大利亚的药品定价同样与偿付报销情况密切相关。澳大利亚将药品分为两类,若药品被纳入到药物福利计划(PBS),即医疗保险药品目录(可获得偿付报销),则由政府有关部门制定药品价格,并与制药企业进行协商谈判;若药品未被纳入到 PBS,则由制药企业自主定价。澳大利亚PBS覆盖了包括罕用药在内的大部分药品。因此,本小节主要介绍PBS内的罕用药价格情况。
通过澳大利亚药品管理局(TGA)上市批准的药品,可提出进入药物福利计划(PBS)的申请,药物福利咨询委员会(PBAC)将对该药品进行评估,并将评估建议提交给澳大利亚卫生部。若PBAC同意向卫生部推荐该药品,则由药物福利定价委员会(PBPA)与申请人进行药品价格协商谈判。申请人应向PBPA提交有关该药品的资料信息,如成本、预计售价、利润、预算影响等。
澳大利亚将PBS内的药品分为F1和F2两类。F1类包含仅有一种品牌的药物(无其它仿制药),主要为专利药物;F2类包含具有多种品牌或多种同类产品的药物(有其它仿制药),主要为非专利药物。大部分罕用药属于F1类药品,PBPA在制定某药品价格时,通常考虑以下因素:
①PBAC关于该药品的临床和成本-效果建议;
②其它替代品牌的价格;
③同一治疗化学组(ATC)中其它药物的价格;
④由制药企业提供或 PBPA计算的成本信息;
⑤处方量、规模经济、其它因素如(有效期、储存要求、产品稳定性、特殊制造要求);
⑥该药物在海外国家(一般为英国、新西兰)的价格;
⑦ 申请人希望 PBPA 考虑的其他因素;
⑧卫生部部长的任何指示。PBPA与申请人进行多次价格协商谈判,若双方协商一致,则签署一份药品价格确认协议。PBPA将协商的药品价格提交到卫生部,由卫生部部长做出最终决定。若申请人无法与 PBPA达成一致,不接受协商的药品价格,则该药品不得进入PBS,可由制药企业自主定价或重新申请进入PBS。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。



