重磅抗肿瘤新药的中国速度
发布时间:2019-01-16 13:32:44作者:徐轩来源:医药经济报
2018年国内上市的51个新药中,包括16款重磅抗肿瘤产品,占据三分之一
2018年, 在美国,FDA批准上市56款新药,创历史新高;在中国,NMPA批准了51个新药,成绩同样瞩目。
近年来,我国鼓励创新药的政策逐步落实,药品审评审批速度明显加快,一大批创新药集中上市。目前,肿瘤市场是整个医药行业最火的领域,不管外资企业还是内资企业,都在积极布局自己的肿瘤产品线。
2018年,NMPA批准的新药仍以抗癌药居多,进口和国产抗癌新药获批数量快速增加,国内新药审评审批速度明显加快。从获批适应症来看,主要涉及肺癌、肝癌、黑色素瘤、淋巴瘤、白血病、宫颈癌、卵巢癌、乳腺癌、直肠癌、前列腺癌和多发性骨髓瘤等。
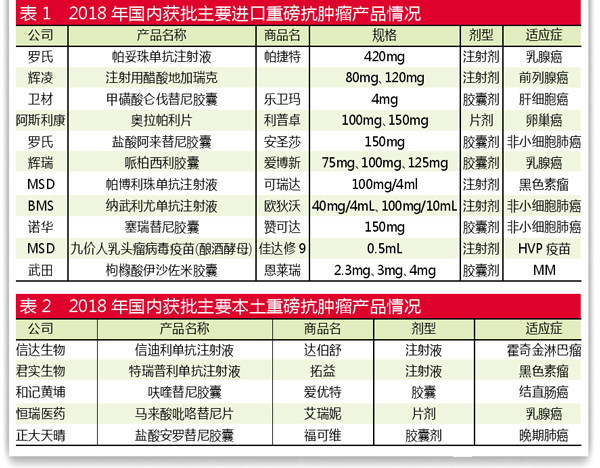
从2018年获批的16款重磅肿瘤产品来看,进口产品有11款,国产产品有5款,占据全部获批药物的三分之一。
进口新品加速上市
1.非小细胞肺癌
★纳武利尤单抗
[制药公司]百时美施贵宝
[获批时间]2018年6月15日
2018年6月15日,百时美施贵宝的纳武利尤单抗注射液获国家药品监督管理局批准上市,商品名为欧狄沃(Opdivo),规格为100mg/10ml、40mg/4ml两种。该产品主要用于治疗非小细胞肺癌,是目前国内第一个获批用于肺癌治疗的PD-1抑制剂,从而开启国内肺癌免疫治疗时代。
2018年8月20日,百时美施贵宝公布了欧狄沃在中国的建议零售价,体重50kg的患者每个月的治疗费用约为27780元,几乎是全球最低价。在该公司上市沟通会上,百时美施贵宝表示,Opdivo将通过实施多元化的举措,响应各级医保谈判等方式,促进Opdivo在中国的可及性。
★阿来替尼
[制药公司]罗氏
[获批时间]2018年8月15日
2018年8月15日,罗氏的新一代ALK抑制剂阿来替尼获国家药监局批准上市,商品名为安圣莎,用于治疗间变性淋巴瘤激酶阳性的局部晚期或转移性非小细胞肺癌。阿来替尼将为ALK阳性非小细胞肺癌患者带来全新的治疗选择。
目前,我国已批准9个非小细胞肺癌小分子靶向口服药物,分别是:阿斯利康与齐鲁的吉非替尼、贝达药业的埃克替尼、辉瑞的克唑替尼、罗氏的厄洛替尼、阿斯利康的奥希替尼、勃林格殷格翰的阿法替尼、正大天晴的盐酸安罗替尼、诺华的塞瑞替尼、罗氏的阿来替尼。后5种是2017年后才在国内上市的产品。
★塞瑞替尼
[制药公司]诺华
[获批时间]2018年5月31日
2018年5月31日,诺华的第二代ALK靶向药物塞瑞替尼获国家药监局批准上市,商品名为赞可达,主要适用于ALK融合突变的非小细胞肺癌患者。该药在中国上市是用于二线治疗,针对的是使用一代靶向药物克唑替尼后出现进展或不耐受的患者。在中国的肺腺癌中,大约有6%左右有ALK融合突变,ALK突变在不吸烟患者中比例要大很多,占10%~15%。
2017年,塞瑞替尼被原国家食品药品监督管理总局药品审评中心纳入优先审评,进入上市快车道。对于一代克唑替尼临床治疗失败或不能耐受的患者,塞瑞替尼相比化疗有更大的疗效优势,能够进一步延缓疾病进展、延长生存。
2.乳腺癌
★哌柏西利
[制药公司]辉瑞
[获批时间]2018年7月31日
2018年7月31日,辉瑞的CDK4/6抑制剂哌柏西利获国家药监局批准上市,商品名为爱博新,主要用于一线联合芳香化酶抑制剂,治疗激素受体(HR)阳性、HER2阴性的绝经后的局部晚期或转移乳腺癌女性患者。哌柏西利为国内首个上市的CDK4/6抑制剂。
目前FDA共批准了3款CDK4/6抑制剂药物,分别是:辉瑞的哌柏西利、诺华的Ribociclib和礼来的Abemaciclib。其中,后两款药物还未在国内上市。
CDK4/6抑制剂是近几年的热门靶点,国家药监局数据显示,齐鲁制药递交的哌柏西利胶囊化学药品仿制申请生产变更为受理状态,为当前国内申报速度最快的企业。除辉瑞和齐鲁外,目前还有豪森、恒瑞、海正、正大天晴等13家企业正在进行临床试验。
★帕妥珠单抗
[制药公司]罗氏
[获批时间]2018年12月17日
2018年12月17日,罗氏的乳腺癌新药帕妥珠单抗获得国家药监局批准上市,商品名为帕捷特,主要用于高复发风险的HER2阳性早期乳腺癌患者的辅助治疗,开启了帕妥珠单抗联合曲妥珠单抗临床乳腺癌“金标准”治疗新时代。
帕妥珠单抗联合曲妥珠单抗和化疗双靶治疗方案,使具有高复发风险的HER2阳性早期乳腺癌患者复发或死亡风险降低25%,让更多患者离治愈目标更近了一步。
中国是乳腺癌高发国,每年有30万乳腺癌新增病例,患者众多,HER单抗市场巨大。在进口抗癌药零关税、国家医保谈判、多个国产曲妥珠单抗类似药接近申报上市的大背景下,帕妥珠单抗的获批上市无疑将给中国乳腺癌患者提供更加丰富的治疗选择。
3.肝癌
★甲磺酸仑伐替尼
[制药公司]卫材
[获批时间]2018年9月4日
2018年9月4日,卫材的肝癌新药仑伐替尼获得国家药监局批准上市,商品名为乐卫玛,主要用于无法切除的肝细胞肝癌(HCC)的一线治疗。仑伐替尼是一种多靶点激酶抑制剂,可以阻滞肿瘤细胞内包括VEGFR1-3、FGFR1-4、PDGFRα、KIT、RET在内的一系列调节因子。
2015年2月,甲磺酸仑伐替尼以优先审评和孤儿药身份获得FDA批准上市,用于治疗放射性碘难治的高风险分化型甲状腺癌。2016年5月,该药被FDA批准联合Afinitor治疗既往接受过anti-VEGF疗法的晚期肾细胞癌患者。
中国是肝癌大国,每年有大约39.5万例新确诊肝癌患者和38万例肝癌死亡患者。索拉非尼是首个有明确证据显示能够改善晚期肝癌患者生存期的系统治疗药物,也是国内肝细胞癌患者的临床一线标准用药。
4.卵巢癌
★奥拉帕利
[制药公司]阿斯利康
[获批时间]2018年8月22日
2018年8月22日,阿斯利康的卵巢癌新药奥拉帕利获得国家药监局批准上市,商品名为利普卓,主要用于铂类敏感复发性卵巢癌的维持治疗,且不论患者是否携带BRCA基因突变。奥拉帕利成为中国首个获批的PARP抑制剂,开启了国内卵巢癌的靶向治疗新时代。
2018年7月,国家药监局发布了《接受药品境外临床试验数据的技术指导原则》,在48个境外已上市临床急需新药名单中,奥拉帕尼正式列入48种可豁免临床直接上市的进口癌症药物之一。奥拉帕尼是国内第一个受益于该政策的进口药物,标志着治疗卵巢癌PARP抑制剂新疗法正式登陆中国市场。
5.黑色素瘤
★帕博利珠单抗
[制药公司]默沙东
[获批时间]2018年7月25日
2018年7月25日,默沙东的PD-1单抗帕博利珠单抗获得国家药监局批准上市,商品名为可瑞达,主要用于一线治疗失败的不可切除或转移性黑色素瘤患者。该产品成为继百时美施贵宝纳武利尤单抗注射液之后第2款正式在中国上市的进口PD-1单抗类药物。
默沙东的Keytruda中国上市时间比百时美施贵宝的Opdivo晚1个多月,两者适应症各不相同。Opdivo主要用于二线治疗非小细胞肺癌,Keytruda则主要用于一线治疗后疾病发生进展的局部晚期或转移性黑色素瘤。
本土产品当仁不让
1.黑色素瘤
★特瑞普利单抗注射液
[制药公司]君实生物
[获批时间]2018年12月17日
2018年12月17日,君实生物的特瑞普利单抗注射液的上市申请正式获得国家药监局批准,商品名为拓益,主要用于治疗既往接受全身系统治疗失败后的不可切除或转移性黑色素瘤。从2018年3月递交上市申请,到以优先审评方式获批,第一家国产PD-1的中国上市审批历时284天。国产PD-1的面世,将对已进入中国市场的进口产品Opdivo和Keytruda形成冲击。
君实生物的特瑞普利单抗于2016年1月获批开展临床试验。2018年3月,特瑞普利单抗以黑色素瘤适应症上市申请获得国家药监局受理,同时在美国开展Ⅰ期临床试验。2018年12月2日,君实生物的特瑞普利单抗注射液的办理状态变更为“在审批”,从“在审批”状态到批准上市用时15天。
百时美施贵宝的Opdivo获批适应症是二线治疗非小细胞肺癌,默沙东的Keytruda获批适应症是晚期恶性黑色素瘤,君实生物特瑞普利单抗上市初期将会与默沙东的Keytruda共同争夺市场,未来将会凭借价格优势攻城略地。
2.霍奇金淋巴瘤
★信迪利单抗注射液
[制药公司]信达生物
[获批时间]2018年12月27日
2018年12月27日,信达生物与礼来制药宣布,其共同开发的PD-1单抗信迪利单抗注射液获国家药监局批准上市,商品名为达伯舒。这是继2018年12月17日君实生物的特瑞普利单抗获批以后的第二款国产PD-1抗体,主要用于至少经过二线系统化疗的复发或难治性经典型霍奇金淋巴瘤的治疗。
信迪利单抗是由信达生物和礼来制药在中国共同合作开发的PD-1单抗,通过与T细胞表面的PD-1受体结合,阻断其与配体PD-L1之间的结合,使T细胞和自身免疫发挥正常作用,进而消灭肿瘤细胞。
2018年4月,信迪利单抗纳入优先审评通道。2018年12月13日,信迪利单抗显示已完成审评工作,进入行政审批阶段,2018年12月27日获得批准上市。信迪利单抗除了用于至少经过二线系统化疗的复发或难治性经典型霍奇金淋巴瘤的治疗之外,还针对多个适应症开展了临床研究,包括肺癌、食管癌、胃癌和霍奇金淋巴瘤等。
3.结直肠癌
★呋喹替尼胶囊
[制药公司]和记黄埔
[获批时间]2018年9月4日
呋喹替尼胶囊由和记黄埔医药研制开发,于2018年9月获国家药监局批准上市,商品名为爱优特,剂型为胶囊剂,规格为100mg,主要用于治疗转移性结直肠癌。该产品为境内外均未上市的创新药,通过优先审评审批程序获准上市,上市后备受业界瞩目。
呋喹替尼一种具有高度选择性的肿瘤血管生成抑制剂,该药从研发到上市历时10多年。呋喹替尼在治疗转移性结直肠癌上有较强优势,作为国产创新药物,其市场前景值得期待。
4.乳腺癌
★马来酸吡咯替尼片
[制药公司]恒瑞
[获批时间]2018年8月12日
2018年8月12日,恒瑞自主研发的重磅创新药马来酸吡咯替尼片获得国家药监局有条件批准上市,商品名为艾瑞妮,剂型为片剂,规格为80mg、160mg,主要用于治疗复发或转移性乳腺癌。该产品属于我国自主研发的创新药,通过优先审评审批程序获准上市。
乳腺癌是全球女性癌症中发病率较高的恶性肿瘤,具有很大的市场潜力。乳腺癌治疗一般按临床进程分为新辅助治疗、术后辅助治疗和晚期解救治疗。马来酸吡咯替尼片为复发或转移性乳腺癌患者提供了新的治疗手段。
目前吡咯替尼国内市场上的主要竞品有曲妥珠单抗和拉帕替尼,两个进口产品已进入中国市场。由于吡咯替尼临床疗效表现出色,被誉为“口服赫赛汀”,加上乳腺癌市场竞争空间较大,该产品将成为恒瑞阿帕替尼之后的又一重磅创新药。
5.晚期肺癌
★安罗替尼胶囊
[制药公司]正大天晴
[获批时间]2018年5月8日
安罗替尼是正大天晴自主研发的1.1类新药,2018年5月8日获得国家药监局批准上市,商品名为福可维,剂型为胶囊剂,规格为8mg、10mg、12mg三种。该产品是新型小分子多靶点酪氨酸激酶抑制剂,能有效抑制VEGFR、PDGFR、FGFR、c-Kit等激酶,具有抗肿瘤血管生成和抑制肿瘤生长的双重功效。
近年来,随着NSCLC一线、二线治疗药物的发展,晚期NSCLC患者的治疗得到改善;但对于一线、二线治疗失败的患者,现有的三线治疗手段较为缺乏且选择混乱,患者往往处于无药可用的困境。在这种情况下,安罗替尼的问世,为中国晚期NSCLC患者提供了一种有效的全新治疗手段。安罗替尼在市场上颇具竞争力,有望成为晚期非小细胞肺癌患者三线治疗的标准用药。
结语<<<
回顾2018年,国家药监局正在加快新药在中国的上市速度,已开放了多条快速审批通道,进口重磅肿瘤产品上市明显加速。随着我国医药研发水平的不断提高,自主创新能力有了很大提升,特别是在国家重大新药创制专项政策支持下,已经有越来越多的本土药企从仿制向创制转变,越来越多的一类肿瘤新药正在诞生。2018年中国已然迎来创新药丰收年!
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。



