2018辉瑞新药大丰收 BMS再吞零
发布时间:2019-01-16 11:21:11作者:Amirah Al Idrus 编译/廖联明 来源/Fierce Biotech来源:医药经济报
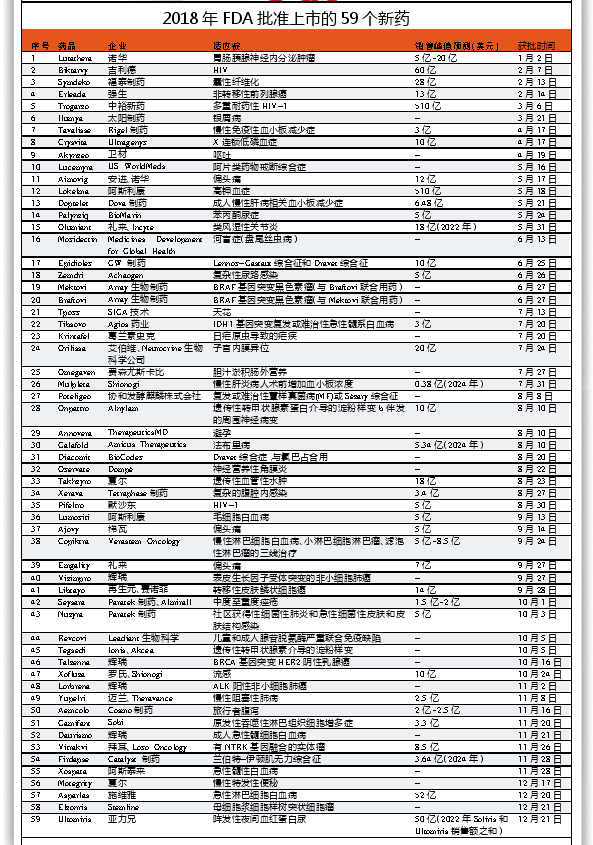
如果说2017年FDA在试图弥补损失的时间,2018年就是超高速运转,CDER一共批准了59个新分子实体(NME)上市。2017年有46个新分子实体获批上市,也相当不错,而在2016年的低迷之时只有22个获批上市。
2018年获批的新药数超过了1996年53个的纪录,Fierce Biotech对这些新药进行了分析。
治疗领域:
抗癌、孤儿药热,丙肝药遇冷
从治疗领域来看,获批抗癌药最多,共有16个新药上市。其中,血液肿瘤的新药略多于实体瘤新药。阿斯利康(AstraZeneca)的Lumoxiti与Verastem公司的Copiktra均被批准用于血液肿瘤的三线治疗,前者用于治疗毛细胞白血病,后者用于治疗慢性淋巴细胞白血病、滤泡性淋巴瘤和小淋巴细胞淋巴瘤。
有几种药物被用于突变明确的肿瘤:Array生物制药的Mektovi与Braftovi用于治疗BRAF基因突变黑色素瘤,Agios公司的Tibsovo用于治疗IDH1基因突变的复发或难治性急性髓性白血病;还有3只来自辉瑞(Pfizer)的药物——治疗EGFR基因突变非小细胞肺癌(NSCLC)的Vizimpro、治疗ALK阳性NSCLC的Lorbrena、治疗BRCA基因突变HER2阴性乳腺癌的Talzenna。最受关注的是拜耳(Bayer)与Loxo的高选择性TRK抑制剂Vitrakvi,这是一种“和组织类型无关”的药物,用于治疗那些携带神经营养受体酪氨酸激酶融合基因的肿瘤患者。
罕见病新药的获批数量几乎与抗癌新药相当。血小板减少症方面有两个新药上市,即Doptet与Tavalisse。Alylam公司的Onpattro和Akcea/Ionis公司的Tegsedi也获得了上市批准,都是用于治疗遗传性转甲状腺素淀粉样变性(hATTR)。Onpattro是第一个获批的用来治疗源于hATTR的多发性神经病的药物,同时也是第一个小干扰RNA类(siRNA)药物。
GW制药的Epidiolex成为FDA批准的首个大麻药物,用于治疗两种罕见的癫痫类型——Dravet和Lennox-Gastaut综合征。Epidiolex的活性成分是大麻二酚,在美国属于“目前未有医疗用途”的I类药物,在GW公司推出该药前,必须由美国缉毒局(DEA)重新分类。虽然DEA只会批准大麻二酚用于制备Epidiolex,但该药的历史性获批可能为其他从事大麻药物研究的公司铺平道路。
过去几年,丙肝新药一直是药企的重点研发对象,但其在2018年的上市新药中不见踪影,而抗HIV和偏头痛都有3款新药上市。吉利德(Gilead)的抗HIV复方药物Biktarvy的销售峰值预计最高可达100亿美元,该药的及时上市将帮助吉利德缓解其丙肝药物面临的竞争压力。Taimed公司的Trogarzo被批准用于多耐药的HIV-1,是十多年来第一个有新作用机制的抗HIV药物。
偏头痛也是一个热门领域,多家公司争先希望自己的产品成为首个上市的CGRP抑制剂。安进(Amgen)和诺华(Novartis)开发的Aimovig争得头名,于2018年5月获批上市。梯瓦(Teva)的Ajovy和礼来(Eli Lilly)的Emality在9月也紧跟着上市,预计还有更多的CGRP抑制剂会陆续上市。艾尔健(Allergan)和Biohaven都在研究口服的CGRP抑制剂,这对患者来说是一个更具吸引力的选择。
制药企业:
辉瑞收获最多,BMS连续两年无新药
不少药企在2018年推出了新药,从数量上来看,辉瑞(Pfizer)独占鳌头。虽然该公司直到9月才有第一个新药获批上市,但在两个多月的时间里,其最终获批了4个新药,均为抗肿瘤药物。辉瑞在2018年获批的第二个新药是PARP抑制剂Talzenna,被FDA批准用于治疗BRCA基因突变的HER2阴性乳腺癌,该公司正进行扩大其应用范围的研究,包括卵巢癌、胰腺癌和肺癌。
大多数其他企业只上市了一个新药,夏尔(Shire)和阿斯利康等上市了两个新药,拜耳、礼来、诺华(Novartis)和Shionogi也上市了两个,但其第二个获批新药都是与其它公司合作的。百时美施贵宝(Bristol-Myers Squibb)连续第二年在新药上没有收获,也是唯一一家没有新药上市的全球Top 15药企。
2018年药品获批数量增长的背后是什么?Evercore ISI分析师乔恩·米勒(Jon Miller)表示,很难说全球都有这样一种趋势:“这波浪潮有其必然性,也就是说,FDA在过去几年里已经越来越宽松。这并不是说他们的宽松政策导致有问题的新药也上市了,但他们对新药的某些要求可能有所降低。”
米勒以2016年引发争议的获批新药Exondys 51举例:“FDA越来越愿意,尤其是在罕见病和完全无药可治的、病人数量有限的疾病上放宽新药的上市标准,而这些新药在5年或10年前可能因为疗效证据不充分而被拒绝。”
虽然有些人认为Exondys 51是根据“相对不可靠的证据”获批上市的,但米勒指出,这并不一定意味着FDA会按照类似的松紧度审评所有的新药。他不认为FDA思维的演变局限于过去两年:“这是一个发展阶段的趋势,上市新药数量有自然的涨落,就像研发线上的试验药物数量有自然的涨落一样。”
米勒认为,更具说服力的统计数据是上市率,或每年上市的新药数量占申请总量的百分比。但这可能很难追踪,因为FDA不会公开已提交但未上市的申请,被拒绝的申请相关信息的唯一来源是药企宣布收到了FDA的完全回应函、需要提供更多数据的要求函等通知。
“根据监管机构的统计数据,申请数量也有所上升,但增长率并不相同。这一上涨趋势可能在很大程度上反映了FDA为更快、更有效地将新药推向市场所做的努力。许多人认为,数字的激增也是对新药疗效要求降低的结果。”EP Vantage在其2019年的展望报告中写道。
这种“温和的监管环境”对医药行业未来意味着什么?“许多牛市都是由超宽松的FDA推动的。”一位投资者表示,“这让生物技术企业和投资者都更大胆地承担风险。”但Vantage也提醒,如果行业在某些情况下被鼓励过快地向前推进,而损害药品对患者的有效性和安全性,以及投资者在商业前景方面的利益,从长远看,一个宽松的监管时代可能会损害行业。
编译/廖联明
来源/Fierce Biotech
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。



