2018年欧盟批准药物成绩单
发布时间:2019-01-15 17:59:37作者:李轩(中国医药工业研究总院)来源:医药经济报
欧盟药品市场约占世界药品市场的40%,药品监管体系比较系统和完善,在国际药品市场中起着十分重要的作用。那么,2018年欧盟批准药物究竟交出了一份怎样的成绩单呢?
2019年1月4日,欧盟药品管理局(European Medicines Agency,EMA)及时发布了2018年推荐上市的人用药物概要。
84个获批上市、65个增加适应症
2018年,EMA共计推荐上市84个药物,不予推荐上市5个药物(EnCyzix, Dexxience, Eladynos, Alsitek与Exondys),10个上市许可申请被撤回。此外,2018年EMA共计推荐批准65个药物增加新适应症。
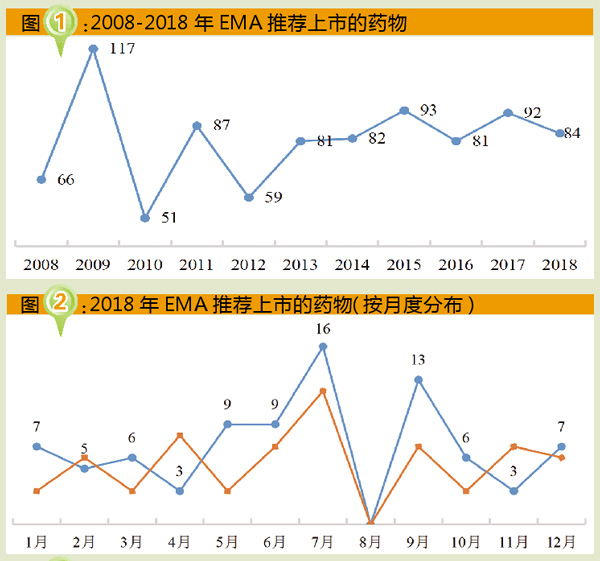
从2008-2018年EMA推荐上市药物的年度数量来看,2009年推荐上市117个药物,数量最多;而2010年仅推荐上市51个药物,数量最少;年均推荐上市81个药物(具体情况见图1)。
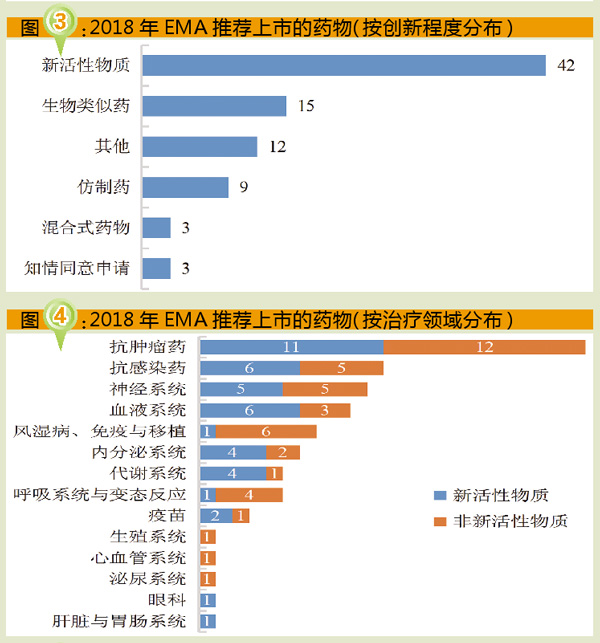
从2018年EMA推荐上市药物的月度数量来看,7月推荐上市16个药物,数量最多;8月未推荐上市药物;月均推荐上市7个药物(详见图2)。
42个NAS、15个生物类似药
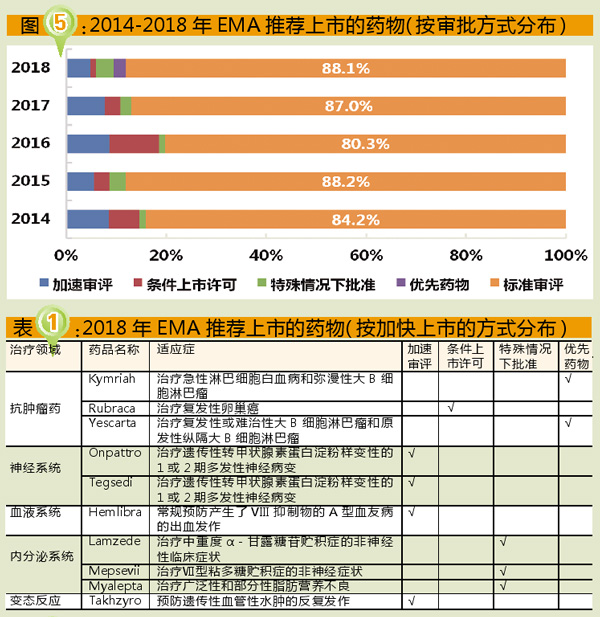
如图3所示,2018年EMA推荐上市的药物中,新活性物质(new active substance, NAS)42个,占50%;生物类似药(biosimilar medicine)15个,约占18%;仿制药(generic medicine)9个,约占11%;知情同意申请(informed consent application)3个,约占4%;混合式药物(hybrid medicine)3个,约占4%。
混合式药物是一种与已上市药物含有相同活性物质的药物,但在剂量、适应症或剂型等方面与已上市药物不同,其上市许可申请部分依赖于已上市药物的临床前和临床试验结果,部分依赖于新数据。
欧洲的生物类似药市场是世界上最成熟的生物类似药市场。2018年EMA推荐上市的15个生物类似药,可谓大丰收。其中培非格司亭生物类似药5个(Pelgraz、Udenyca、Fulphila、Pelmeg、Ziextenzo),阿达木单抗生物类似药4个(Halimatoz、Hefiya、Hyrimoz、Hulio),曲妥珠单抗生物类似药3个(Kanjinti、Trazimera、Ogivri)。从企业情况来看,数量位居前三位的依次是:山德士(5个)、迈兰(4个)、辉瑞(2个)。
TOP3领域:抗肿瘤、抗感染、神经系统
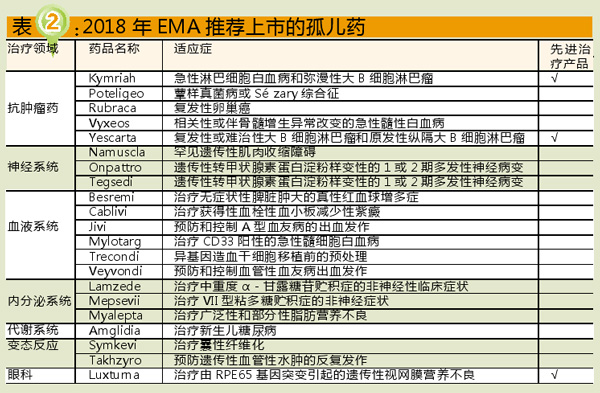
2018年EMA推荐上市的药物中,抗肿瘤药23个,约占27%;抗感染药11个,约占13%;神经系统用药10个,约占12%。可见,目前药物研发热点依旧集中于抗肿瘤药、抗感染药等领域(具体情况见图4)。与2017年相比,抗肿瘤药、神经系统用药的数量持平;内分泌系统用药减少6个,抗感染药减少4个;而血液系统用药增加5个,代谢系统用药、疫苗各增加3个。
仅10个加速途径获批:提速政策未显效
2018年EMA推荐上市的药物中,4个药物获得加快审评(accelerated assessments),1个药物获得条件上市许可(conditional marketing authoristations),3个药物获得特殊情况下批准(approval under exceptional circumstances),2个获得优先药物(PRIority MEdicines, PRIME)资格(具体情况见表1)。
EMA在加强对药品安全、有效和质量监管的同时,采取多种有效途径,促进临床急需药物上市。如特殊情况下批准(1993年)、加速审评(2004年)、条件上市许可(2006年)与优先药物资格(2016年)等。但是,从近年来欧盟药物加快上市的数据来看,相关政策还没有充分发挥作用,则体现出EMA的谨慎态度。
21个孤儿药:突破性新药潜力地带
2018年EMA推荐上市的药物中,孤儿药(orphan medicine)21个,占25%;先进治疗产品(advanced therapy medicinal products, ATMPs)3个(Kymriah、Yescarta和Luxturna),约占4%。新的孤儿药具有显著改善患者生活的潜力。ATMPs是以基因或细胞为基础的药物,给疾病的治疗提供突破性的新机会。它们对于严重的、无法治愈的或传统方法无法根治的慢性疾病尤为重要(具体情况见表2)。
其中,Kymriah是诺华研发的全球首个CAR-T细胞免疫疗法药物,Yescarta是第二个CAR-T药物,由吉利德与Kite制药共同开发;两者均以CD19为作用靶点,并首先由FDA于2017年批准。2018年6月,EMA人用药品委员会(Committee for Medicinal Products for Human Use, CHMP)推荐批准这两款药物。Kymriah与Yescarta也是首批通过EMA的“优先药物计划”获得CHMP肯定意见的药物。
Luxturna则是由Spark Therapeutics研发的全球首个眼科基因疗法药物,首先由FDA于2017年批准。2018年9月,EMA推荐批准此款药物。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。



