加拿大非顶级公司新药比例增加
发布时间:2019-01-15 16:38:10来源:医药经济报
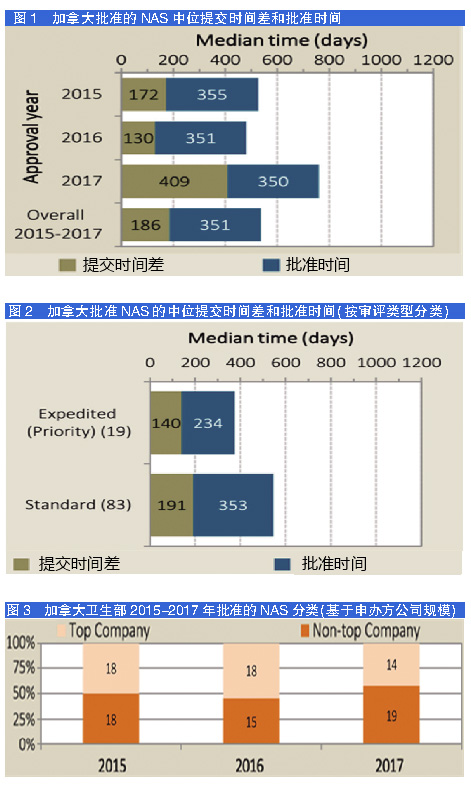
2017年,加拿大卫生部的中位提交时间差与前两年相比翻了一番达到409天,而2015和2016年分别为172天和130天。
与之相反,中位批准时间则保持相当的相似性(见图1)。2015-2017年总体提交时间差和批准时间基于审评类型进行分析可以发现,获得加速(优先)审评指定的NAS的更短的提交时间差(见图2)。这表明无论公司还是监管机构,都对解决高度未满足需求的重要产品的提交和批准进行快速跟踪。
虽然2017年加拿大卫生部的中位提交时间差大幅增加,但与2015和2016年相比,总体时间差的变化幅度(25和75百分位数)相似,大约是450~550天。
根据申办方规模的不同,提交到加拿大卫生部的中位提交时间差也随之不同,非顶级公司(顶级公司定义为2016 年研发预算超过30 亿美元的公司)无论中位值还是变化幅度都更大(图3)。2017年,非顶级公司的中位提交时间差是595天,2016年为157天,2015年是833天。2017年,来自于非顶级公司的NAS比例与2016年(45%)和2015年(50%)相比增高,达到58%。
2017年数据
2017年,加拿大卫生部共批准了33个NAS,中位批准时间350天。
其中,有13个生物NAS获得批准,中位批准时间332天;有20个化学NAS获得批准,中位批准时间359天。
有9个抗癌和免疫调节NAS获得批准,中位批准时间270天;24个其他治疗领域NAS的中位批准时间为354天。
6个加速审评的NAS获得批准,中位批准时间209天;这比27个标准审评NAS的中位批准时间快141天。
加拿大卫生部没有孤儿药政策,但2017年有12个被FDA、EMA或者TGA定义为孤儿药的NAS被加拿大卫生部批准,中位批准时间为265天。
2017年加拿大卫生部批准的NAS中,有15%是在加拿大卫生部首次获得批准,或者是在EMA、FDA、PMDA、Swissmedic或TGA批准后一个月之内获得批准。
85%首先在EMA、FDA、PMDA、Swissmedic或TGA获得批准,或者是批准一个月以上后再在加拿大卫生部获得批准的NAS,在加拿大卫生部的中位提交时间差是491天。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。



