PMDA药审途径: 日本公司更积极更高效
发布时间:2019-01-10 16:43:38作者:科睿唯安来源:医药经济报
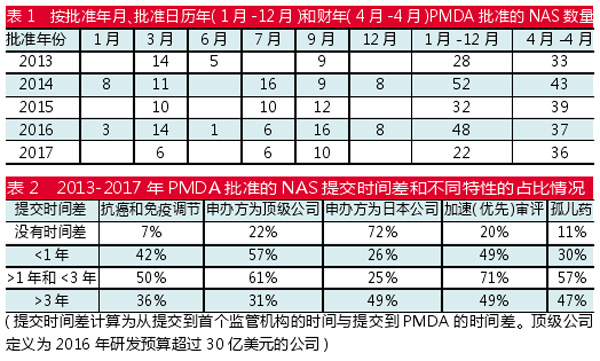
对2013-2017年五年数据(1月-12月)比较可以发现,2017年PMDA批准的NAS数量最低,为22个,2016年这个数字是48。然而,按财年分析批准数据可以发现,最近两年的数值保持稳定,分别是37个和36个。
实际上,PMDA每个财年(4月-4月)通常批准药物四次,因此,与其他一年中任意时间都进行批准的监管机构如FDA相比,按日历年度分析可能会导致批准总数同比波动。
2017年,PMDA的提交时间差是254天,与2016年度的763天相比有大幅下降。这可能是由于日本的公司改变了提交策略,以及遗留的产品时间差距影响减小的结果。
基于提交时间差长度对2013-2017年PMDA批准的NAS进行分析。其中,25%是PMDA独有的(没有时间差;仅在PMDA获得批准),这些产品主要是由日本公司开发的。大部分药物的提交时间差低于一年(29%)或者在1~3年(15%),这些主要是高需求产品,即加速审评、孤儿药或者抗癌和免疫调节NAS。
然而,30%的NAS提交时间差超过3年,特别是一些较小的公司(非顶级公司)以及寻求日本当地申办方来开发产品的跨国公司,这些公司可能会因为策略推迟向PMDA提交申请时间。
2017年批准情况
2017年PMDA共批准22个NAS,中位批准时间333天。其中,7个为生物NAS,中位批准时间331天;15个为化学NAS,中位批准时间343天。
从治疗领域看,有11个为抗癌和免疫调节NAS,中位批准时间304天;其他治疗领域有11个NAS,中位批准时间359天。
此外,8个NAS为加速审评,中位批准时间275天;这比14个标准审评NAS的中位批准时间快82天。7个NAS为孤儿药,中位批准时间281天,这比15个非孤儿药NAS的中位批准时间快74天。
2017年PMDA批准的NAS中,18%是在PMDA首次获得批准,或者是在FDA、EMA、加拿大卫生部、Swissmedic或TGA批准后一个月之类获得批准。82%是首先在EMA、FDA、加拿大卫生部、Swissmedic或TGA获得批准,或者是批准一个月以上后再在PMDA获得批准的,这些NAS在PMDA的中位提交时间差是524天。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。



