NAS获批愈发国际化
发布时间:2018-12-26 10:50:53作者:科睿唯安来源:医药经济报
研究所有六家监管机构批准的产品,可真正地比较它们的监管趋势。进一步分析还原和比较过去十年的两个时间段:2008-2012年和2013-2017年,以确定是否还有一些趋势存在。
有趣的是,被所有六家监管机构都批准的药物总数,从2008-2012年的12个,增至2013-2017年的51个(图1),这说明在同一时间段里有更多的产品正变得国际化。
影响NAS(批准新活性物质)注册的多个潜在因素可决定注册时间的总长度(提交时间+批准时间)(图2)。这些因素包括公司在特定监管机构提交的策略,或者设定的批准时间点。而NAS的类型,以及监管机构为有前景的药物所提供的旨在解决未满足医疗需求的加速途径,反过来又影响了这些因素。
两个时间段注册时间最快的监管机构都是FDA。原因包括公司倾向于选择首先在FDA提交注册,以及FDA更高效的快速监管审评。
提交到EMA的时间几乎和FDA同步,注册总体时间在减少,这可能反映出EMA对重要产品增加了加速途径的使用。
EMA和FDA之后,提交到加拿大卫生部、Swissmedic和TGA的时间差大约为80~100天,在两个时间段不尽相同。
虽然时间差最大的是PMDA,但与2008-2012年相比,2013-2017年提交时间差减少了大约一半,批准时间也有大幅减少,这可能反映出该机构更广泛地使用了加速审评,也显示出其在加速药物审评上的努力。PMDA最显著的变化包括增加资源,引入讨论临床试验结果的事前评估会议,以及在新药申请提交前大约6个月开展事前评估咨询。
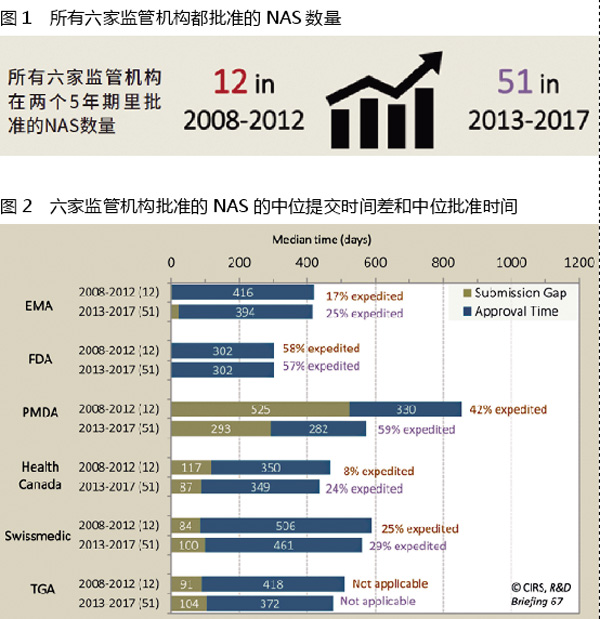
注:提交时间差(Submission Gap)计算为从提交到首个监管机构的时间与提交到目标监管机构的时间差。“加速审评”(expedited)是指EMA的“加速评估”(Accelerated Assessment)以及FDA、PMDA、HC和Swissmedic的“优先审评”(Priority Review);TGA于2017年引入加速(优先)审评计划,预计将在2018年做出首个加速审评决定。批准时间(Approval Time)计算为从提交申请到监管机构批准所花费的时间,这个时间包括监管机构和公司所花费的时间;EMA批准时间包括欧盟委员会的审查时间。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。



