孤儿药“热”,新药获批量创新高
发布时间:2018-12-26 10:23:50作者:灯芯来源:医药经济报
罕见病是指那些发病率极低的疾病,又称“孤儿病”。全球公认的罕见病约7000种,占所有疾病总数十分之一左右。
罕见病在各个国家或区域的定义和标准存在差异。WHO把罕见病定义为患病人数占人口比例的0.65%~1%之间的疾病,而美国的罕见病定义为患者人数低于20万,日本的定义则指患者人数低于5万。中国对罕见病还没有确切定义,但根据罕见病发展中心(CORD)更新的最新参考名录,共收录了121种罕见病,患者人群总数约2000万人。
四大因素助推
近年来,许多大型药企及新兴药企纷纷投入大量的人力、财力进行孤儿药开发。美国《ACS药物化学通讯》总结表明,孤儿药市场变“热”是多方面因素综合促进的成果。
1.政策因素
1983年,美国FDA率先颁布《罕见病用药法》,激励企业开发孤儿药。随后,日本、欧盟和韩国分别在1993年、1999年和2003年颁布相应的孤儿药开发激励措施。各国激励措施的核心内容在于:孤儿药可被加快审批、享受申请费及税收减免福利,且上市后有6~12年的市场独占权等。从新药研发的角度看,以孤儿药身份进入市场,享受市场独占期后再拓展适应症,不失为一种“以奇致胜”的临床开发战略。
国内罕见病政策虽一度处于缺位状态,但近年陆续有相关政策出台,如将孤儿药纳入医保目录、孤儿药优先审评政策、《第一批罕见病目录》出台和成立中国罕见病联盟等。
2.市场因素
各大主流疾病领域的药物开发加速,药物数量也急剧增加,市场趋向饱和。这些疾病领域的药物开发压力不断增大,新上市药物在价格、报销标准上均存在很大压力。而很多罕见病药物市场远未达到饱和,虽然市场相对较小,但相应药物开发企业也少,市场需求很大。而且这类疾病药物一旦开发成功,可迅速获取较大的市场占有率,获得更高的价格补偿。
3.技术推进因素
飞速发展的科学技术,让罕见病药物的识别变得更加精准,开发更加简便可行。80%的罕见病都是遗传性疾病,基因组学和基因测序技术的进步,让开发者分析出许多常见疾病是多种单独(遗传的)罕见病的组合。且基因疗法、反义疗法等技术使得罕见病可进行靶向治疗。
4.制药企业自身因素
传统大型制药企业虽主攻研发主流药物,但近年来药物市场竞争加剧,新兴药企不断抢占市场份额。这些压力迫使大型药企转移一部分注意力来开发孤儿药。而对于小型新兴企业,主流治疗领域的竞争会让其“应接不暇”,也没有那么多的财力与大型制药企业去竞争市场份额,而有政策鼓励的孤儿药市场就成了其发展的机会,选择孤儿药市场也让这些小型药企在最大程度上逃避了与大型药企的竞争。
此外,药企的技术背景会促进其选择相应领域的孤儿药开发。如开发熟悉领域的药物:一直致力于癫痫药物开发的制药企业,会倾向于开发罕见癫痫综合征药物。或者是老药新用:对某一个药物的研究透彻后,可用该药物尝试治疗罕见病。还有就是治疗机制导向:如戈谢氏病为罕见病,研究发现其生物学特性与帕金森病相似,故帕金森病药物开发企业会更有兴趣去开发戈谢氏病药物。
前11月
FDA批准29个孤儿药
在美国,自1983年孤儿药法案通过并取得巨大成功以来,孤儿药是“重磅炸弹”的摇篮,有的甚至是药企巨头的支柱。直到今天,美国关于孤儿药的政策红利还在释放。
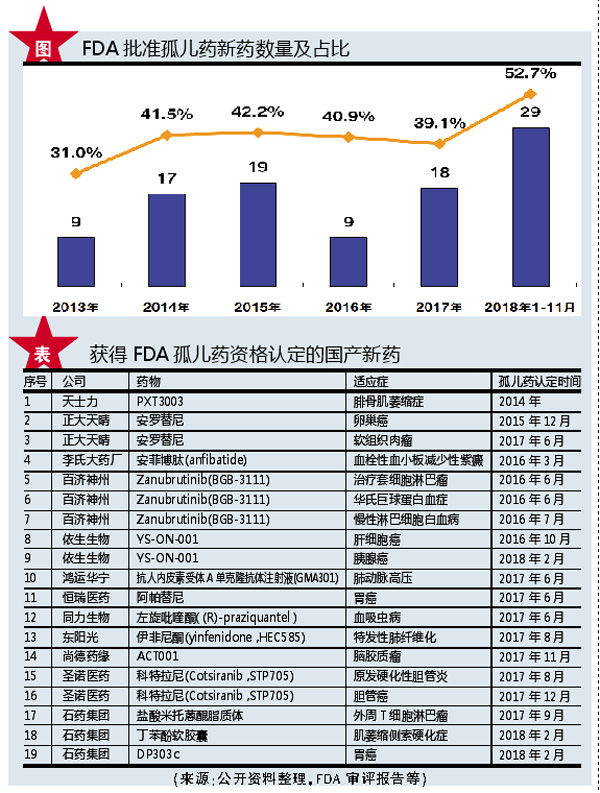
在FDA新药审批越来越严格情况下,FDA为孤儿药上市审批给予了更多空间。2018年1-11月,FDA孤儿药新分子实体(NME)获批数量为29个,占前11月NME获批总数比例高达52.7%,创历史新高。
国内研发升温
在中国,虽然自2007年以来,各机构对孤儿药开发有一些零星的指导方针和意见,但对罕见病的官方定义或罕见病药品的明确监管途径直到近年才出现。
2016年,罕见病治疗和支持专家委员会在国家卫生健康委员会旗下成立,由不同领域的医学专家及卫生健康保险和卫生健康政策专家组成。
2017年,国家药品监督管理局提出“新型罕见病药品”的十年独占权(与美国的505b(1)新药申请相媲美)和“改良型新型罕见病药品”的三年独占权。
2018年5月22日,国家卫生健康委员会、科技部、工业和信息化部、国家药品监督管理局、国家中医药管理局五部门联合发布《第一批罕见病》目录,共涉及121种疾病,涵盖各种遗传病。
2018年10月24日,中国罕见病联盟正式成立,向社会各界提供专业的国家首批罕见病目录释义。
上述措施和政策的落实对孤儿药开发具有重要意义,也为审查和营销激励提供了具体细节。
同时,鉴于获FDA批准的药物相对更容易被其他市场认可,因此国内创新药企若选对了适应症,通过申报FDA“孤儿药资格认定”,采取中美双报的开发策略,更是抢占了国内注册的先机,实现“弯道超车”。近年来,中国医药企业开始看到孤儿药市场蕴藏的巨大价值,纷纷进行孤儿药研发布局。据不完全统计,已经有14款来自中国药企的新药拿到了19项FDA孤儿药资格认定。其中,百济神州的BTK抑制剂Zanubrutinib(BGB-3111)获得3项孤儿药资格认定,正大天晴的安罗替尼、依生生物的YS-0N-001和圣诺医药的科特拉尼(Cotsiranib,STP705)皆获得了2项FDA孤儿药资格认定。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。



