加速审评通道加宽
发布时间:2018-12-25 14:29:04作者:科睿唯安来源:医药经济报
加速审评通道加宽
FDA获批数量最多、EMA占比增长最快
“加速审评”是指EMA的“加速评估”(Accelerated Assessment)以及FDA、PMDA、加拿大卫生部和Swissmedic的“优先审评”(Priority Review)。TGA于2017年引入加速(优先)审评计划,预计将在2018年做出首个加速审评的决定。
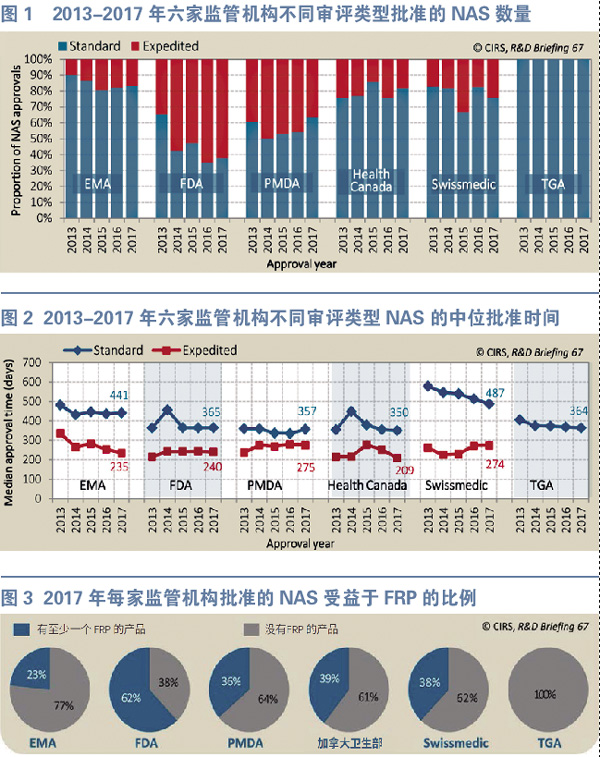
目前所有六家监管机构都已经提供加速优先审评的途径,旨在加速有前景的NAS的审评过程(图1)。
TGA于2017年实施了优先审评流程,但是当年并没有授权任何加速批准。尽管如此,该机构一直在接受优先审评的申请,预计2018年将会授权首个加速审评。
2016年,加速批准/标准批准比最高的监管机构是FDA(62%),接下来依次是PMDA(36%)、Swissmedic(24%)、HC(18%)和EMA(17%)。过去几年中,FDA和PMDA的加速批准占比一直很高。
实际上,与2008-2012年相比,2013-2017年五家监管机构都增加了加速批准的比例(TGA除外,因TGA于2017年才引入加速/优先审评计划)。其中,EMA的增幅最大,从2008-2012年的7%增至2013-2017年的16%;其次是Swissmedic(从10%增至22%)、PMDA(从22%增至45%)、FDA(从43%增至55%)和加拿大卫生部(从18%增至21%)。
EMA加速批准比例的大幅增长,可能是该机构2015年修订加速评估(Accelerated Assessment)指南的结果,更新版的指南希望能优化公司对这个工具的使用。尽管如此,还需要更多的时间来确定EMA优先审评(Priority Review)途径的使用是否会进一步增加。特别是2016年该机构推出了优先药物计划(PRIME),该计划专门用于促进加速评估用于解决未满足医疗需求的药物。
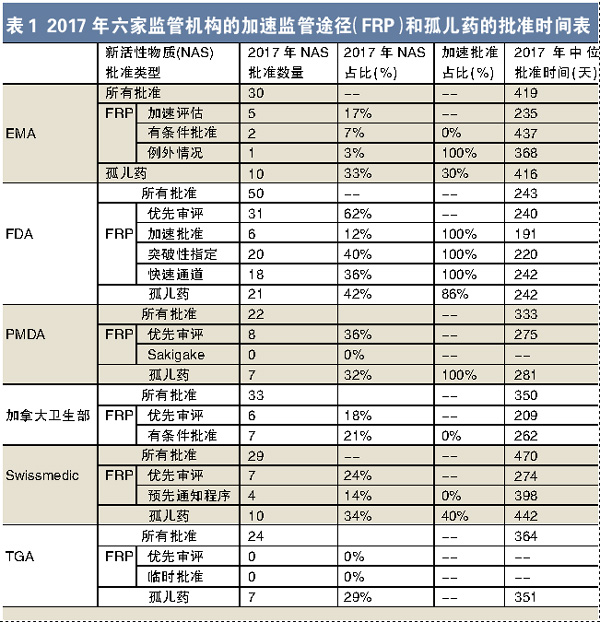
2017年,Swissmedic以标准流程批准NAS的中位批准时间连续第五年减少,自2013年以来下降了91天。Swissmedic也是2017年加速审评和标准审评中位批准时间差异最大的监管机构,差距为213天(图2)。差距最小的是PMDA(82天)。其他监管机构的时间差分别为:EMA 206天,加拿大卫生部141天,FDA 125天。TGA于2017年引入了优先审评,审评时间为150天(仅指监管机构的时间),与EMA相同。
六家监管机构中,FDA提供了最多的加速监管途径(FRP)(表1)。2017年,FDA批准的NAS中62%受益于至少一种可用的FRP,其他监管机构这一比例在20%~40%(图3)。2017年,在五家监管机构的各种FRP中,FDA加速评估途径的中位批准时间最快(191天)。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。



