FDA审批还在提速
发布时间:2018-12-25 13:52:15作者:科睿唯安来源:医药经济报
六大监管机构十年新药审批专题
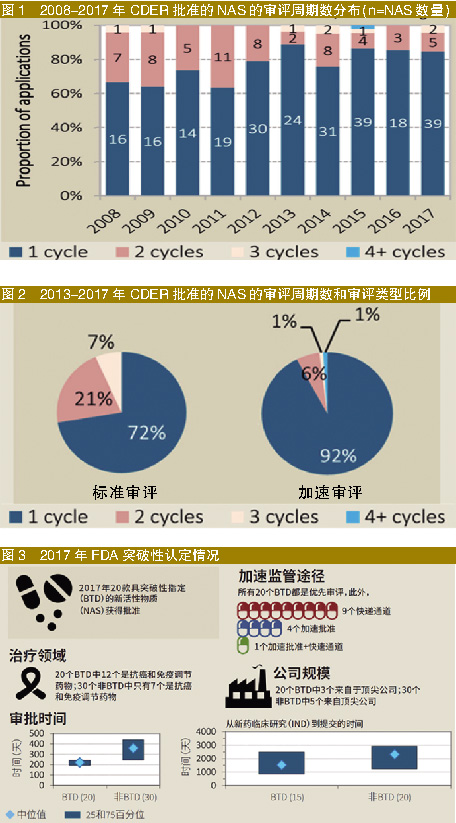
FDA药品评估和研究中心(CDER)经一个周期评审即予批准的NAS占比,从2008-2012年的70%增至2013-2017年的84%(图1)。
此外,2013-2017年,与标准审评相比,加速审评一个周期即予批准的比例更高(图2)。
这反映出CDER在进一步优化审评流程(特别是一个周期审评即批准)方面所做出的努力。一个周期审评数量的增加,可能说明提交文档的质量更高,而这反过来又会对审评效率产生积极影响。需要注意的是,这个分析(图1)仅包括已经批准的药物,若纳入未获批的药物,可能会产生不同的观点。
2017年,FDA创历史记录地批准了20个具有突破性疗法认定(BTD)的NAS,占2013年FDA启动BTD以来所有获得批准的具BTD的NAS的41%(图3)。获得BTD的NAS通常还获得其他加速批准(包括优先审评、快速通道和加速审评),并且通常是来自大型药企的抗癌和免疫调节药物。更重要的是,BTD指定缩短了批准时间和开发时间(IND到提交)。
2017年NAS情况
2017年,FDA(CDER和CBER)共批准了50个NAS,中位批准时间243天。其中16个为生物NAS,中位批准时间为241天;34个为化学NAS,中位批准时间为244天。
从治疗领域看,有19个抗癌和免疫调节NAS获得批准,中位批准时间为214天;其余领域有31个NAS,中位批准时间为293天。
31个加速审评的NAS获得批准,中位批准时间240天。这比2017年19个标准审评NAS批准的中位批准时间快125天。
21个孤儿药获得批准,中位批准时间为242天,这比2017年29个非孤儿药NAS批准的中位批准时间快92天。
2017年FDA批准的NAS中,86%是在FDA首次获得批准,或者是在EMA、PMDA、加拿大卫生部、Swissmedic或TGA批准后一个月之类获得批准。
其余14%首先在EMA、PMDA、加拿大卫生部、Swissmedic或TGA获得批准,或者是批准一个月以上后再在FDA获得批准的NAS,在FDA的中位提交时间差为175天。
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。



