六机构审批效率趋同: FDA最快、最稳定
发布时间:2018-12-06 14:52:03作者:科睿唯安来源:医药经济报
2008-2017年的十年间,六大主要监管机构——欧洲药品管理局(EMA)、美国食品药品监督管理局(FDA)、日本药品和医疗器械局(PMDA)、加拿大卫生部(Health Canada,HC)、瑞士医药管理局(Swissmedic)和澳大利亚医疗用品管理局(TGA)的监管环境都有变化,同时跨国药企的战略也发生了改变。这些变化使得药物上市授权时间缩短,获批药物数量增加。具体来说,获得六大监管机构批准的药物总数从2008-2012年的12个增至2013-2017年的51个。
影响新药提交和批准所需时间的基本因素包括公司战略、审评流程的执行和类型,以及产品的类型和治疗领域。
尽管如此,决定申请提交的可能性和时间点的一个关键因素是申办方的规模。如果一个药物由一家规模较小的公司开发,那么药物在首个国家提交申请后,就不太可能再去其他国家寻求上市了。
2017年,批准新活性物质(NAS)最多的监管机构是FDA(50个),其次是加拿大卫生部(30个)、EMA(30个)、Swissmedic(29个)、TGA(24个)和PMDA(22个)。尽管这些数字每年都在变化,但是从三年移动平均值看,六家监管机构批准的新活性物质(NAS)总数在增加。
比较2008-2012年以及2013-2017年两个时间段各个监管机构批准的NAS数量可以发现,批准数量变化最大的是TGA(增加56%),其次是加拿大卫生部和EMA(增加46%)、Swissmedic(增加41%)、FDA(增加38%)和PMDA(增加26%)。
各个监管机构批准药物的数量出现年度差异有很多原因,比如公司向每家监管机构提交申请的策略都是不同的,而公司策略又基于公司规模、未满足的医疗需求以及机构审评速度而变化。另一个原因是审评时间。如FDA全年持续批准NAS;而PMDA只在一年中某些特定的时间点批准NAS。
2017年,FDA是中位批准时间最短的监管机构(243天)。这可能是由于加速监管途径(FRP)在这一年被广泛使用,大约40%的NAS批准获得了突破性疗法指定,凸显那些产品在解决未满足医疗需求上的重要性。
其他监管机构的中位批准时间由短到长排列依次是:PMDA(333天)、加拿大卫生部(350天)、TGA(364天)、EMA(419天)和Swissmedic(470天)。
整体来说,六家监管机构的中位批准时间趋势相似,但最快和最慢的机构(不包括FDA)之间的差值为137天。
近年来,各监管机构批准时间的变化也很小(25%~75%),特别是TGA、FDA、EMA和PMDA。在审评时间上则显得更为一致。这可能是多种因素造成的,比如EMA和TGA在批准程序和流程上进行立法,提高了公司提交申请的质量;各监管机构实施了多种质量措施,如提交前的工作,在审评开始前验证文档的质量,并最终提高流程的一致性和及时性。若存在差异,可能是因为该监管机构采用的是标准途径还是加速途径,以便优先审评某些NAS。
(科睿唯安)
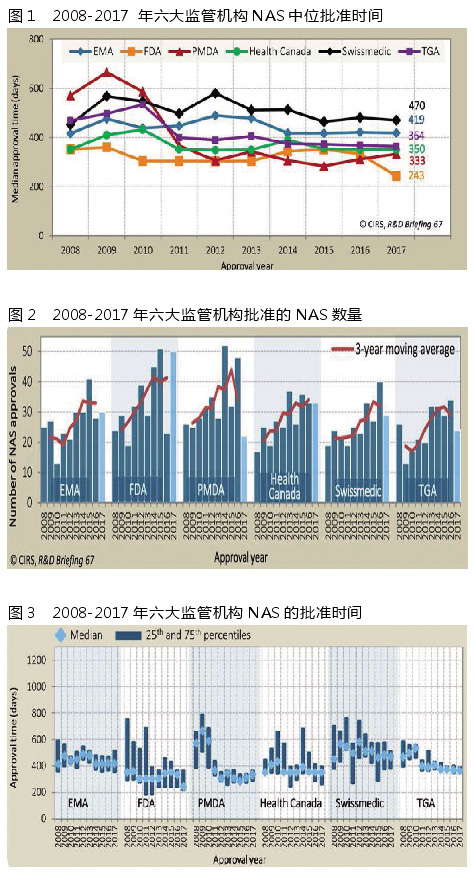
(批准时间计算:从提交申请到监管机构批准所花费的时间。这个时间包括监管机构和公司所花费的时间。EMA批准时间包括欧盟委员会的审评时间)
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。



