EMA官员: 药企应分享新药试验失败数据
发布时间:2018-12-06 14:41:43作者:Enrica Alteri,Lorenzo Guizzaro来源:医药经济报
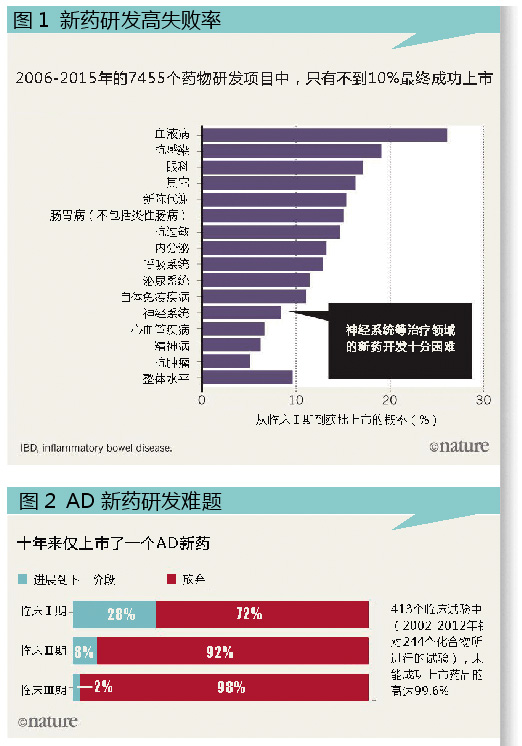
从动物实验到在数千名受试者身上进行Ⅲ期临床试验,一种药物上市可能需要20年甚至更长时间。在进入人体试验阶段的药物中,超过80%无法证明其安全性和有效性,而阿尔茨海默症(AD)新药的失败率更是超过99%。
然而,这些失败背后的数据通常不会被监管机构应用,也不会被参与这些研究以外的人深究。没有这些数据,从失败中吸取教训根本无从谈起。
2015年,欧洲药品管理局(EMA)邀请制药公司讨论关于他们所有AD项目的机密信息。这项数据共享计划的一个重要成果是为设计临床试验和评估患者疗效提出了新建议,这些都在EMA修订后的阿尔茨海默症治疗临床研究指南中得到了体现。
EMA官员Enrica Alteri与Lorenzo Guizzaro近日在《科学》上发表一篇评论指出,他们相信,制药公司彼此间互相学习经验,有助于实现更高效、更有价值的临床试验。如果试验失败的信息能够更早地收集起来,早期临床试验后的下一步决策就可以得到改进。
数据共享已成趋势
Enrica Alteri与Lorenzo Guizzaro认为,对失败试验的数据进行更早、更全面地分析也同样适用于其他复杂病症的新药,这也是监管机构的责任,有助于更快更准确地评估临床试验中药品的疗效。
过去10年,越来越多的药企加入共享生物医学数据和想法的实践中。一些组织,如生物标记物协会(Biomarkers Consortium)和结构基因组学协会(Structural Genomics Consortium),召集了许多企业和学者共同设计实验,如识别疾病标记物或鉴定工具化合物,以了解目标蛋白的工作原理。还有一些组织则要求企业和学术组织在一个公共存储库中共享数据。例如,“数据领域计划”(Project Data Sphere Initiative)是一个分享受试者数据的平台(受试者身份被隐藏保护),这些受试者来自于180多个癌症试验的对照组、安慰剂组,甚至试验组。
更多的从单个试验中获得的数据被分享出来。国际医学期刊编辑委员会(International Committee of Medical Journal Editors)主张把已经提交给出版社发表的大量试验数据予以公布。在这一方面,EMA已经有所行动。完成审评后,EMA会发布药物所有的临床研究报告,以及其对临床前和临床证据的审评意见。不过,对于未能提交上市申请的新药,其相关数据就不会发布。
通常,一些阴性结果的研究会在临床试验注册网站公开,或者刊登在杂志上,但往往不包括这些化合物在临床前或早期研究中的数据。此外,数据从获取到分享的时间间隔通常很长,这增加了从中获取经验的难度。
失败数据或更关键
事实上,没有被共享的信息往往才是最重要的:未能满足药物开发人员希望的数据最有可能有助于推进药物研究的进程。大型临床试验意味着花费数百万美元来验证一个假设,即试验药物的有效性和安全性。Enrica Alteri与Lorenzo Guizzaro认为,这些与预期相反的结果应当被公布出来,以完善假设并研究出新的假设。
AD可能是治疗领域中最合适进行合作研究的病症。过去10年,超过30种药物进入了Ⅲ期临床试验。但到目前为止,这些实验疗法都没有显示出治疗效果,甚至没有达到试验目标,比如阻止或扭转认知能力或日常活动能力的下降。有证据表明,在某些情况下,这些试验开展前没有进行充分的探索性研究。这导致了高失败率,增加了研究人员错失潜在可行的治疗方案的风险,因为即使治疗方案可行,也会由于研究方案的设计不合理(例如选择了错误的剂量或不适当的目标人群)而导致阴性结果,或者得出难以解释的阴性结果。
许多AD新药的研发项目都宣布了令人失望的结果:从2012年开始,由默沙东(Merck)、辉瑞(Pfizer)、强生(Johnson & Johnson)、礼来(Eli Lilly)和罗氏(Roche)开展的备受关注的大型试验的效果都不太理想。
来自八国集团(G8)国家的卫生部长在2013年发表了一份关于痴呆症的政策文件,旨在激励所有参与者采取行动。2015年,世界卫生组织(WHO)在相关行动中呼吁,加大对痴呆症研究的共同努力,促进各方合作。这些举措,加上以往的失败,意味着制药公司面临着巨大的公众压力,需要证明他们正在不断寻求解决方案。其中,自愿与监管机构合作是一种很好的方式。
用失败经验优化研究方法
在G8国家呼吁采取行动后,EMA邀请制药公司在保密协议下各自介绍他们的研究——详细说明研究的药物目标、在研药物可能针对的人群,以及打算如何在试验设计中证明这一点。最终有7家公司同意参加,并分享了14项已经终止或进行中的试验的数据,其中包括总共涉及12000多名参与者的疗效试验。
药企无需提供原始的文档资料,只需介绍设计试验逻辑,以及提供大型临床试验取得令人失望的结果的临床证据。EMA这么做的关键不在于整合数据去执行更强大的统计分析,而是在重新审视药企提供的全部数据的基础上,考虑研发过程中共同面临的问题。
在这项行动中,与EMA共享的信息比通常刊登的论文、在临床试验注册网站公布的或根据法规公开的简明介绍更及时、更广泛、更深入。Ⅲ期临床研究前产生的数据(包括临床前和早期临床研究)的详细信息是至关重要的,有助于了解造成试验失败的重要原因,同时,这些信息也有助于避免意思含糊的通用术语带来的负面结论。
Enrica Alteri与Lorenzo Guizzaro指出,这些数据的共享和分析提高了他们对AD的认识与发展,更重要的是,理解如何调整疾病的假定机制才可能产生临床可检测的效果。例如,潜在的药物分子与目标蛋白的结合程度有多大才能改变其生理机能?药物分子必须穿过血脑屏障才能产生效果的最小百分比是多少?这些参数随着来自多个不同项目的数据而变得更加清晰。
虽然法律上限制了EMA公开某些数据,但相关工作帮助修正了EMA指南。这些指南将有助于设计出能够获得更多信息的AD药物试验和更好的研发项目。例如,人们参加试验前应该评估他们的症状和β-淀粉样蛋白的病理学证据。这使得疾病的进展更加可预测,并提高试验验证新药疗效的能力。这一实践还让EMA能够就如何考虑“并发事件”(如中风或改变药物治疗方案)提出建议,一些年龄较大的受试者在长期试验中不可避免地会遇到这种情况,这也使结果的解释变得复杂。
EMA还发现了结果测量的问题。一些先前使用的公认仪器已经被证明不适合用于早期AD的研究。为了克服这一问题,大多数试验结合了来自各种测量方式的单个项目的数据,测量日常活动中认知表现和身体功能的特定方面。虽然这一战略有其优点,但结果的可解释性比单纯的统计学解析更加重要。此外,不同试验间的不同研究手段增加了结果对比的难度。而EMA修改后的指南中使用更标准化的方法来衡量结果,会带来信息更丰富的试验。
监管方应推动数据共享
为了这个项目,EMA与加拿大、日本和美国的监管机构合作,尽可能地统一要求。制药公司常常称不同的监管要求阻碍了全球药品研发的进程,尽管这仍然是一个挑战,但多方的集中努力可以发现需要大家趋同的地方,如选择研究人群的标准和评估病人疗效的结果指标,这些有助于临床研究。美国FDA修订后的《阿尔茨海默氏症行业指南》(industry guidance on Alzheimer 's disease)反映了这种趋同现象,与之后EMA发布的最新指南提出了相同的建议。
Enrica Alteri与Lorenzo Guizzaro希望,这个项目能够为其他难以治疗的疾病的新药研发起到示范作用。在新的EMA指南指导下,AD药物研发能否产生积极的结果,现在评估还为时过早。尽管如此,Enrica Alteri与Lorenzo Guizzaro希望通过努力来表明,制药研究总体进展所取得的成果可以打消任何一家公司在披露数据时的犹豫。此外,这项工作表明,监管机构可以作为更有效的药品研发的推动者。
为了加快新药研发进度,药企必须更乐于提供数据和想法,而监管机构必须予以支持。毕竟最终的目标是使研发团队获得更多的药品研发数据,加快互相学习的速度。
编译/廖联明 来源/Nature
此内容为《医药经济报》融媒体平台原创。未经《医药经济报》授权,不得以任何方式加以使用, 包括转载、摘编、复制或建立镜像。如需获得授权请事前主动联系:020-37886610或020-37886753;yyjjb@21cn.com。



